ņä£ļĪĀ
ņ×äĒöīļ×ĆĒŖĖ ņ╣śļŻīĻ░Ć ļ│┤ĒÄĖĒÖöļÉśļ®┤ņä£ ļ¼┤ņ╣śņĢģ ļČĆņ£äņØś ņ╣śļŻī ņśĄņģśņ£╝ļĪ£ ņ×äĒöīļ×ĆĒŖĖļź╝ ņäĀĒāØĒĢśļŖö ĒÖśņ×ÉĻ░Ć ņĀÉņĀÉ ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ļŗż. ņ×äĒöīļ×ĆĒŖĖļŖö ņĄ£Ēøäļ░® ĻĄ¼ņ╣śļČĆļź╝ ĒżĒĢ©ĒĢśņŚ¼ Ļ│ĀņĀĢņä▒ Ļ░ĆĻ│ĄņØśņ╣ś ļō▒ ĻĖ░ņĪ┤ņØś ļ│┤ņ▓Ā ņ╣śļŻīĻ░Ć ņ¢┤ļĀżņÜ┤ ļČĆņ£äņŚÉļÅä ņĀüņÜ®ĒĢĀ ņłś ņ׳ņ¢┤, ņ╣śĻ│╝ ņ╣śļŻīņŚÉņä£ ĒĢäņłśņĀüņØĖ ņ╣śļŻīļ▓Ģņ£╝ļĪ£ ņ×Éļ”¼ ņ×ĪņĢśļŗż. ĻĘĖļ¤¼ļéś ņ×äĒöīļ×ĆĒŖĖ ņŗ£ņłĀņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņŚ╝Ļ│╝ Ļ░ÖņØĆ ĒĢ®ļ│æņ”ØņØś ļ░£ņāØļźĀļÅä ļåÆņĢäņ¦ĆĻ│Ā ņ׳ņ£╝ļ®░, ņØ┤ļŖö ņ×äĒöīļ×ĆĒŖĖ ņ╣śļŻīņØś ņןĻĖ░ņĀüņØĖ ņä▒Ļ│ĄļźĀņØä ņ£äĒśæĒĢśļŖö ņżæņÜöĒĢ£ ļ¼ĖņĀ£ļĪ£ ļīĆļæÉļÉśĻ│Ā ņ׳ļŗż[
1,
2].
ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņŚ╝ņØĆ ņ×äĒöīļ×ĆĒŖĖļź╝ ļæśļ¤¼ņŗ╝ ņĪ░ņ¦üņŚÉņä£ Ļ│©ņåīņŗżņØä ļÅÖļ░śĒĢśļŖö ļ│ĄĒĢ®ņĀü ņŚ╝ņ”Øņä▒ ņ¦łĒÖśņ£╝ļĪ£, ņŻ╝ņÜö ņøÉņØĖņØĆ ĻĄ¼Ļ░Ģ ļé┤ ļ░öņØ┤ņśżĒĢäļ”äņØś ņČĢņĀüņØ┤ļŗż[
3]. ļ░öņØ┤ņśżĒĢäļ”äņØĆ ļ│æņøÉņä▒ ņäĖĻĘĀ ĻĄ░ņ¦æņ£╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņĀĖ ņ׳ņ£╝ļ®░, ņØ┤ļōż ņäĖĻĘĀņØ┤ ļīĆņé¼ Ļ│╝ņĀĢņŚÉņä£ ņāØņä▒ĒĢśļŖö ņŚ╝ņ”Øņä▒ ļ¼╝ņ¦łņØ┤ ņ¦łĒÖśņØś ņ¦äĒ¢ēņØä ņ┤ēņ¦äĒĢ£ļŗż4). ĻĘĖļ¤¼ļéś ĻĖ░ņĪ┤ņØś ņ¦äļŗ© ļ░®ļ▓Ģņ£╝ļĪ£ļŖö ņ┤łĻĖ░ ļ│æļ│ĆņØś ņ¦äĒ¢ē ņāüĒā£ļéś ļ»ĖņäĖĒĢ£ ļ░öņØ┤ņśżĒĢäļ”äņØś ņĪ┤ņ×¼ļź╝ ņĀĢĒÖĢĒ׳ ĒÖĢņØĖĒĢśļŖö ļŹ░ ņ¢┤ļĀżņøĆņØ┤ ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ ņ¦äļŗ©ņāüņØś ĒĢ£Ļ│äļĪ£ ņØĖĒĢ┤ ņ┤łĻĖ░ ļ░£Ļ▓¼ņØ┤ ņ¦ĆņŚ░ļÉśļ®┤ņä£ ļ│┤ļŗż ļ│Ąņ×ĪĒĢśĻ│Ā ņ╣©ņŖĄņĀüņØĖ ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢ┤ņ¦ĆļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦Äļŗż[
5,
6].
ĻĖ░ņĪ┤ņØś ņ×äņāüņĀü Ļ▓Ćņé¼ ļ░Å ļ░®ņé¼ņäĀĒĢÖņĀü Ļ▓Ćņé¼, ņ£ĪņĢł Ļ┤Ćņ░░ļ¦īņ£╝ļĪ£ļŖö ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņŚ╝ņØä ņĀĢĒÖĢĒĢśĻ▓ī ĒÅēĻ░ĆĒĢśļŖö ļŹ░ ĒĢ£Ļ│äĻ░Ć ņ׳ļŗż. ĒŖ╣Ē׳ ņ┤łĻĖ░ ļŗ©Ļ│äņØś ņ×æņØĆ ļ│æļ│ĆņØĆ ņ£ĪņĢłņ£╝ļĪ£ ĒÖĢņØĖĒĢśĻĖ░ ņ¢┤ļĀĄĻ│Ā, ļ░®ņé¼ņäĀ ņ┤¼ņśüļ¦īņ£╝ļĪ£ļŖö ņĪ░ņ¦üņØś ļ»ĖņäĖĒĢ£ ļ│ĆĒÖöļź╝ ņČ®ļČäĒ׳ ĒÅēĻ░ĆĒĢśĻĖ░ņŚÉ ĒĢ£Ļ│äĻ░Ć ņ׳ļŗż[
7]. ņØ┤ļ¤¼ĒĢ£ ļ¼ĖņĀ£ļź╝ ĒĢ┤Ļ▓░ĒĢśĻĖ░ ņ£äĒĢ┤ ņāłļĪ£ņÜ┤ ņ¦äļŗ© ĻĖ░ņłĀņØś ļÅäņ×ģ ĒĢäņÜöņä▒ņØ┤ ļīĆļæÉļÉśņŚłņ£╝ļ®░, ņĄ£ĻĘ╝ņŚÉļŖö quantitative light-induced fluorescence(QLF)ņÖĆ Ļ░ÖņØĆ biofluorescence imaging system(BIS) ĻĖ░ņłĀņØ┤ ĒśüņŗĀņĀüņØĖ ļīĆņĢłņ£╝ļĪ£ ņŻ╝ļ¬®ļ░øĻ│Ā ņ׳ļŗż[
8].
QLFļŖö ļ╣äņ╣©ņŖĄņĀü ļ░®ņŗØņ£╝ļĪ£ ĒŖ╣ņĀĢ ĒīīņןņØś ņ▓Łņāē Ļ░Ćņŗ£Ļ┤æņäĀ(405 nm)ļź╝ ņĪ░ņé¼ĒĢśņŚ¼, ņäĖĻĘĀ ļīĆņé¼ ņé░ļ¼╝ņØĖ Ēżļź┤Ēö╝ļ”░ņŚÉņä£ ļ░£ņāØĒĢśļŖö ņĀüņāē ĒśĢĻ┤æņØä Ļ░Éņ¦ĆĒĢĀ ņłś ņ׳ļŗż[
9]. ņØ┤ļź╝ ĒåĄĒĢ┤ ļ░öņØ┤ņśżĒĢäļ”äņØś ņä▒ņłÖļÅä ļ░Å ļ│æņøÉņä▒ņØä ņĀĢļ¤ēņĀüņ£╝ļĪ£ ĒÅēĻ░ĆĒĢĀ ņłś ņ׳ņ£╝ļ®░, ĒŖ╣Ē׳ QLFļŖö ļ░öņØ┤ņśżĒĢäļ”äņØś ļ»ĖņäĖĒĢ£ ļČäĒżĻ╣īņ¦Ć ņŗ£Ļ░üņĀüņ£╝ļĪ£ ĒÖĢņØĖĒĢĀ ņłś ņ׳ņ¢┤ ņ¦äļŗ©ņØś ņĀĢĒÖĢļÅäļź╝ Ē¢źņāüņŗ£ĒéżĻ│Ā ņ╣śļŻī Ļ│äĒÜŹ ņłśļ”ĮņŚÉ Ēü░ ļÅäņøĆņØä ņżä ņłś ņ׳ļŗż[
9,
10]. ņäĀĒ¢ē ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ QLFļź╝ ĒÖ£ņÜ®ĒĢśļ®┤ ļ░öņØ┤ņśżĒĢäļ”äņØś ņ£äņ╣śņÖĆ ļČäĒżļź╝ ļ│┤ļŗż ļ¬ģĒÖĢĒĢśĻ▓ī ĒÅēĻ░ĆĒĢĀ ņłś ņ׳ņ£╝ļ®░, ĒśĢĻ┤æ Ļ░ĢļÅäļź╝ ĒåĄĒĢ┤ ļ│æļ│ĆņØś ņŗ¼Ļ░üļÅäļź╝ ņ”ēĻ░üņĀüņ£╝ļĪ£ ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŗż[
9,
11]. ĻĘĖļ¤¼ļéś QLFļź╝ ĒÖ£ņÜ®ĒĢ┤ņä£ ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņŚ╝ņØä ĒÅēĻ░ĆĒĢśĻ▒░ļéś ņ╣śļŻī ņĀäĒøäņØś ĒśĢĻ┤æņØś ļ│ĆĒÖöļź╝ ĒÅēĻ░ĆĒĢ£ ņ×äņāü ņŚ░ĻĄ¼ļŖö ļČĆņĪ▒ĒĢ£ ņŗżņĀĢņØ┤ņŚłļŗż.
ļö░ļØ╝ņä£ ļ│Ė ņ”ØļĪĆ ļ│┤Ļ│ĀņŚÉņä£ļŖö QLF(Qraypen C, AIOBIO, Seoul, Korea)(
Fig. 1)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ×äĒöīļ×ĆĒŖĖ Ēæ£ļ®┤ņØś ļ░öņØ┤ņśżĒĢäļ”äņØä ņŗżņŗ£Ļ░äņ£╝ļĪ£ ņĖĪņĀĢĒĢśĻ│Ā, ņĀ£Ļ▒░ ņĀĢļÅäļź╝ ĒÅēĻ░ĆĒĢ©ņ£╝ļĪ£ņŹ© ņ╣śļŻī Ļ▓░Ļ│╝ļź╝ ņ”ēĻ░üņĀüņ£╝ļĪ£ ļČäņäØĒĢ£ ļæÉ Ļ░Ćņ¦Ć ņ”ØļĪĆļź╝ ņåīĻ░£ĒĢśĻ│Āņ×É ĒĢ£ļŗż.
ņ”ØļĪĆ
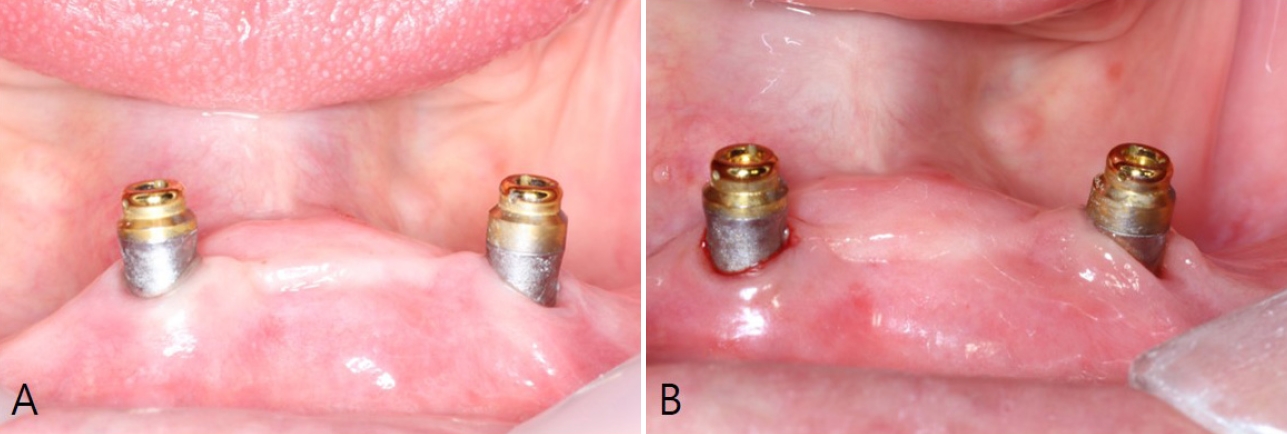
ņ”ØļĪĆ 1
78ņäĖ ņŚ¼ņä▒ ĒÖśņ×ÉĻ░Ć ĒĢśņĢģ ņĀäņ╣śļČĆ #33, 43 ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ļ│ĆņØś ņ×ćļ¬Ė ņŗ£ļ”╝ ļ░Å ņ¦ĆņåŹņĀüņØĖ ļČłĒÄĖĻ░ÉņØä ņŻ╝ņåīļĪ£ ņĀäļČüļīĆĒĢÖĻĄÉ ņ╣śĻ│╝ļ│æņøÉ ņ╣śņŻ╝Ļ│╝ņŚÉ ļé┤ņøÉĒĢśņśĆļŗż. ĒĢ┤ļŗ╣ ĒÖśņ×ÉļŖö ļ│ĖņøÉ ņ╣śņŻ╝Ļ│╝ņŚÉņä£ ņĀĢĻĖ░ņĀüņ£╝ļĪ£ ņ£Āņ¦Ć ņ╣śņŻ╝ ņ╣śļŻīļź╝ ļ░øņĢäņśżļŹś ņżæ, Ļ░£ņØĖņĀüņØĖ ņé¼ņĀĢņ£╝ļĪ£ ņØĖĒĢ┤ 1ļģä 6Ļ░£ņøöĻ░ä ļé┤ņøÉņØ┤ ņżæļŗ©ļÉśņŚłļŗż. ĒÖśņ×ÉļŖö ņć╝ĻĘĖļĀīņ”ØĒøäĻĄ░(Sj├ČgrenŌĆÖs syndrome)Ļ│╝ Ļ│©ļŗżĻ│Ąņ”ØņØä ĻĖ░ņĀĆņ¦łĒÖśņ£╝ļĪ£ Ļ░Ćņ¦ĆĻ│Ā ņ׳ņŚłņ£╝ļ®░, ņןĻĖ░Ļ░ä Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ņØ┤ ņØ┤ļŻ©ņ¢┤ņ¦Ćņ¦Ć ņĢŖņØĆ ņāüĒā£ņŚÉņä£ ņ”ØņāüņØ┤ ņĢģĒÖöļÉśņ¢┤ ļŗżņŗ£ ņ╣śļŻīļź╝ ņøÉĒĢśņśĆļŗż.
ņ×äņāü Ļ▓Ćņé¼ Ļ▓░Ļ│╝, #33, 43 ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņŚÉņä£ ņ¦ĆņåŹņĀüņØĖ ņŚ╝ņ”Ø ņåīĻ▓¼ņØ┤ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░, 6 mm Ļ░Ćļ¤ēņØś ĒāÉņ╣© Ļ╣ŖņØ┤ņÖĆ ĒāÉņ╣©ņŗ£ ņČ£Ēśł, ĻĘĖļ”¼Ļ│Ā ņ╣śņØĆ ņāüļ░®ņ£╝ļĪ£ ņāüļŗ╣Ē׳ ļģĖņČ£ļÉ£ ņ×äĒöīļ×ĆĒŖĖ ļéśņé¼ņäĀņØ┤ ĒĢ┤ļŗ╣ ļ¼ĖņןņŚÉ ĒāÉņ╣©ņŗ£ ņČ£Ēśł ņåīĻ▓¼ņØ┤ ļ│┤ņØĖļŗżļŖö ļé┤ņÜ®ņØä ņČöĻ░ĆĒ¢łņŖĄļŗłļŗż. ļ░®ņé¼ņäĀņé¼ņ¦äņŚÉņä£ļÅä ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņØś Ļ│© ņåīņŗżņØ┤ ĒÖĢņØĖļÉśņŚłņ£╝ļ®░, ĒŖ╣Ē׳ #33 ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņŚÉņä£ ņŗ¼ĒĢ£ Ļ│© ņåīņŗżņØ┤ ņ¦äĒ¢ēļÉ£ ņ¢æņāüņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. ņ£ĪņĢł ĒÅēĻ░Ć Ļ▓░Ļ│╝, ņ×äĒöīļ×ĆĒŖĖ Ēæ£ļ®┤ņŚÉ ņØ╝ļČĆ ļ░öņØ┤ņśżĒĢäļ”äņØ┤ ļČĆņ░®ļÉ£ Ļ▓āņØ┤ ĒÖĢņØĖļÉśņŚłņ£╝ļéś, QLFļź╝ ņØ┤ņÜ®ĒĢ£ ĒÅēĻ░ĆņŚÉņä£ļŖö ņ£ĪņĢłņ£╝ļĪ£ ĒÖĢņØĖļÉśņ¦Ć ņĢŖļŹś ļ»ĖņäĖĒĢ£ ļ░öņØ┤ņśżĒĢäļ”äĻ╣īņ¦Ć ļ¬ģĒÖĢĒĢśĻ▓ī Ļ┤Ćņ░░ļÉśņŚłļŗż. ĒŖ╣Ē׳, QLF ņśüņāüņŚÉņä£ļŖö ļ░öņØ┤ņśżĒĢäļ”äņØ┤ Ļ┤æļ▓öņ£äĒĢśĻ▓ī ņČĢņĀüļÉ£ ņāüĒā£ļź╝ ņŗ£Ļ░üņĀüņ£╝ļĪ£ ĒÖĢņØĖĒĢĀ ņłś ņ׳ņ¢┤, ņØ┤ļź╝ ĒåĄĒĢ┤ ĒÖśņ×ÉņŚÉĻ▓ī ĻĄ¼Ļ░Ģ ņ£äņāØ Ļ┤Ćļ”¼ņØś ĒĢäņÜöņä▒ņØä Ļ░ĢņĪ░ĒĢśņśĆļŗż(
Fig. 2).
ņØ┤ņŚÉ ļö░ļØ╝ ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņŚ╝ņ£╝ļĪ£ ņ¦äļŗ©ĒĢśņśĆņ£╝ļ®░, ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£ä ļ░öņØ┤ņśżĒĢäļ”ä ņĀ£Ļ▒░ļź╝ ņ£äĒĢ┤ ļ©╝ņĀĆ ņ×äĒöīļ×ĆĒŖĖ ņĀäņÜ® ņŖżņ╝ĆņØ╝ļ¤¼ Ēīü (STS-5E, B&L BioTech, Seoul, Korea)ņØä ņé¼ņÜ®ĒĢśņŚ¼ ņ×äĒöīļ×ĆĒŖĖņØś ņĀäņ▓┤ņĀüņØĖ ļČĆņ£äļź╝ ņäĖņĀĢĒĢ£ Ēøä, NiTi ļĖīļ¤¼ņŗ£(TN Brush, Dentium, Seoul, Korea)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ╣śņØĆņŚ░ņāü(supragingival) ņ×äĒöīļ×ĆĒŖĖ Ēæ£ļ®┤ ļČĆņ£äļź╝ ņäĖņĀĢĒĢśĻ│Ā, air-powder abrasive device(PERIOFLOW┬« handpiece, EMS Dental, Nyon, Switzerland)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ╣śņØĆņŚ░ĒĢśļČĆņ£äļź╝ ņäĖņĀĢĒĢśņśĆļŗż. ļ░öņØ┤ņśżĒĢäļ”ä ņĀ£Ļ▒░ Ēøä, ļŗżņŗ£ QLF ņ┤¼ņśüņØä ņŗ£Ē¢ēĒĢśņŚ¼ ņ╣śļŻī ņĀäĒøäņØś ņ░©ņØ┤ļź╝ ĒÅēĻ░ĆĒĢśņśĆņ£╝ļ®░, ņ£ĪņĢł ĒÅēĻ░Ćļ¦īņ£╝ļĪ£ļŖö Ļ╣©ļüŚĒĢ┤ ļ│┤ņśĆļŹś ļČĆņ£äņŚÉņä£ļÅä ņØ╝ļČĆ ņ×öņĪ┤ ļ░öņØ┤ņśżĒĢäļ”äņØ┤ ĒÖĢņØĖļÉśņŚłļŗż. ņØ┤ļź╝ ĒåĄĒĢ┤ ļ│┤ļŗż ļ¬ģĒÖĢĒĢśĻ▓ī ļ░öņØ┤ņśżĒĢäļ”ä ņĀ£Ļ▒░ ņāüĒā£ļź╝ ĒÅēĻ░ĆĒĢĀ ņłś ņ׳ņŚłņ£╝ļ®░, ņČöĻ░Ć ņ▓śņ╣śļź╝ ĒåĄĒĢ┤ ļ│┤ļŗż ņ▓ĀņĀĆĒĢ£ ņäĖņĀĢņØ┤ Ļ░ĆļŖźĒĢśņśĆļŗż. ņØ┤Ēøä, 0.2% Ēü┤ļĪ£ļź┤ĒŚźņŗ£ļöśņ£╝ļĪ£ ņäĖņĀĢņØä ņŗ£Ē¢ēĒĢ£ Ēøä, ņŚ╝ņ”Ø ņĪ░ņĀłņØä ņ£äĒĢ┤ 2% ļ»ĖļģĖņé¼ņØ┤Ēü┤ļ”░ ņŚ░Ļ│Ā(Periocline┬«, Sunstar, Osaka, Japan)ļź╝ ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£ä ļ│æņåīņŚÉ ĻĄŁņåī ņĀüņÜ®ĒĢśņśĆļŗż(
Fig. 3).
2ņŻ╝ Ēøä ļé┤ņøÉ ņŗ£ ĒÅēĻ░ĆĒĢ£ Ļ▓░Ļ│╝, ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£ä ņŚ╝ņ”ØņØ┤ ĒśäņĀĆĒ׳ Ļ░ÉņåīĒĢśņśĆņ£╝ļ®░, ņĪ░ņ¦ü ņāüĒā£Ļ░Ć ņ¢æĒśĖĒĢśĻ▓ī ņ£Āņ¦ĆļÉśĻ│Ā ņ׳ņŚłļŗż. ņ╣śļŻī Ēøä ņ×äĒöīļ×ĆĒŖĖ Ēæ£ļ®┤ņØĆ Ļ╣©ļüŚņØ┤ ņ£Āņ¦ĆļÉśņŚłņ£╝ļ®░, ņČöĻ░ĆņĀüņØĖ ņŚ╝ņ”ØņØĆ ļ░£Ļ▓¼ļÉśņ¦Ć ņĢŖņĢśļŗż. ĒÖśņ×ÉļŖö ņ×äņāüņĀüņ£╝ļĪ£ ļČłĒÄĖĻ░ÉņØä ĒśĖņåīĒĢśņ¦Ć ņĢŖņĢśņ£╝ļ®░, ĻĄ¼Ļ░Ģ ļé┤ ņ”ØņāüļÅä ĒśĖņĀäļÉśņŚłļŗż. 6Ļ░£ņøö Ēøä Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ļ░Å ņ£Āņ¦Ć ņ╣śļŻīļź╝ ņ£äĒĢ┤ ņ×¼ļé┤ņøÉĒĢ£ Ļ▓░Ļ│╝, ņŻ╝ļ│ĆņŚÉ ļ»ĖņĢĮĒĢ£ ņŚ╝ņ”Ø ņåīĻ▓¼ņØ┤ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļéś, ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£ä ņĪ░ņ¦üņØĆ ņĢłņĀĢņĀüņ£╝ļĪ£ ņ£Āņ¦ĆļÉśĻ│Ā ņ׳ņŚłĻ│Ā, ņČöĻ░ĆņĀüņØĖ Ļ│© ņåīņŗżņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż(
Fig. 4).
ņ”ØļĪĆ 2
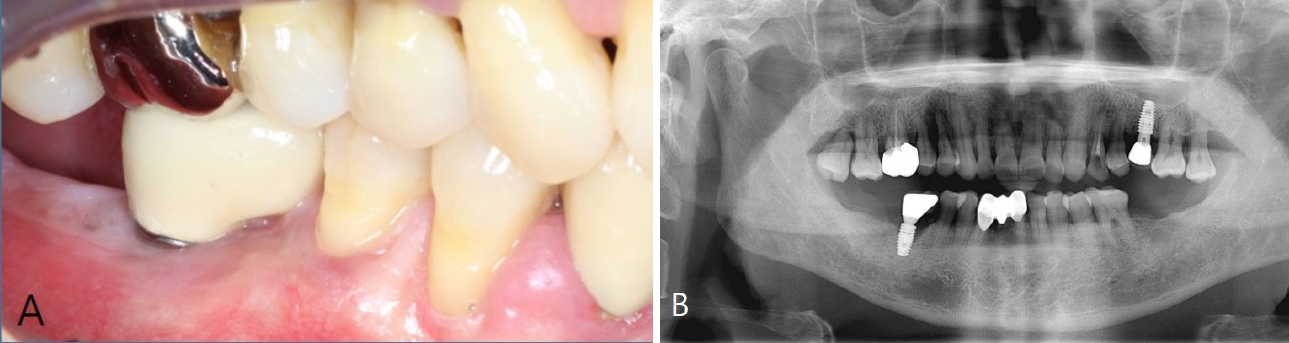
61ņäĖ ļé©ņä▒ ĒÖśņ×ÉĻ░Ć #46 ņ×äĒöīļ×ĆĒŖĖņØś ļéśņé¼ ĒÆĆļ”╝ņØä ņŻ╝ņåīļĪ£ ņĀäļČüļīĆĒĢÖĻĄÉ ņ╣śĻ│╝ļ│æņøÉ ņ╣śĻ│╝ļ│┤ņ▓ĀĻ│╝ņŚÉ ļé┤ņøÉĒĢśņśĆņ£╝ļ®░, ĒĢ┤ļŗ╣ ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņØś ņ¦ĆņåŹņĀüņØĖ ņČ£ĒśłĻ│╝ ļČłĒÄĖĻ░Éņ£╝ļĪ£ ņØĖĒĢ┤ Ēśæņ¦ä ņØśļó░ļÉśņ¢┤ ņ╣śņŻ╝Ļ│╝ņŚÉ ļ░®ļ¼ĖĒĢśņśĆļŗż. ĒÖśņ×ÉļŖö Ļ│Āņ¦ĆĒśłņ”Ø ņÖĖņŚÉ ļŗżļźĖ ĻĖ░ņĀĆņ¦łĒÖśņØĆ ņŚåņŚłņ£╝ļ®░, #46 ņ×äĒöīļ×ĆĒŖĖļŖö ņĢĮ 5ļģä ņĀä ņ¦ĆņŚŁ ņ╣śĻ│╝ņŚÉņä£ ņŗØļ”ĮļÉśņŚłņ£╝ļéś, ĒĢ┤ļŗ╣ ņ╣śĻ│╝Ļ░Ć ĒÅÉņŚģĒĢ£ ņāüĒā£ļĪ£ ļ│ĖņøÉ ņ╣śņŻ╝Ļ│╝ņŚÉņä£ ņ╣śļŻīļź╝ ļ░øĻĖ░ļź╝ ņøÉĒĢśņśĆļŗż.
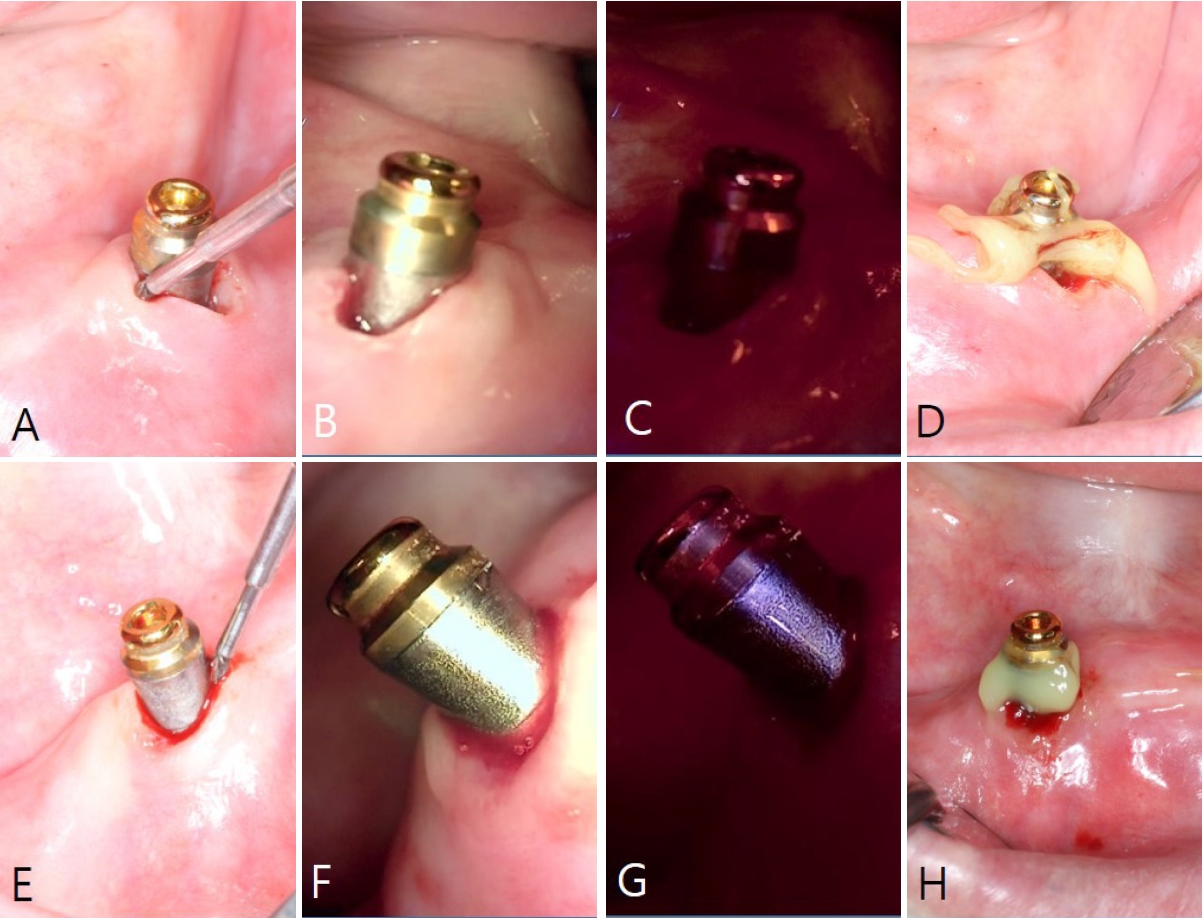
ņ×äņāü Ļ▓Ćņé¼ Ļ▓░Ļ│╝, #46 ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ļ│ĆņŚÉ 6 mm ņØ┤ņāüņØś Ļ╣ŖņØĆ ņ╣śņŻ╝ļéŁņØ┤ ĒśĢņä▒ļÉśņ¢┤ ņ׳ņŚłņ£╝ļ®░, ĒāÉņ╣© ņŗ£ ņČ£ĒśłņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. ļ░®ņé¼ņäĀņé¼ņ¦äņŚÉņä£ļŖö ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņØś Ļ│© ņåīņŗżņØ┤ ĒÖĢņØĖļÉśņŚłņ£╝ļ®░, ĻĄ¼Ļ░Ģ ļé┤ ņĀäļ░śņĀüņØĖ ņ╣śņŻ╝ņŚ╝ļÅä ļÅÖļ░śļÉśņ¢┤ ņ׳ņŚłļŗż. ņØ┤ņŚÉ ļö░ļØ╝, ņÜ░ņäĀņĀüņ£╝ļĪ£ ņ¢æņĖĪ ņāüņĢģ ņĀ£3ļīĆĻĄ¼ņ╣ś ļ░£ņ╣śļź╝ ļÅÖļ░śĒĢ£ ņĀäņĢģņØś ļ╣äņÖĖĻ│╝ņĀü ņ▓śņ╣ś(ņŖżņ╝ĆņØ╝ļ¦ü ļ░Å ņ╣śĻĘ╝ĒÖ£ĒāØņłĀ)ļź╝ ņŗ£Ē¢ēĒĢ£ Ēøä, QLFļź╝ ĒÖ£ņÜ®ĒĢ£ #46 ņ×äĒöīļ×ĆĒŖĖ Ēæ£ļ®┤ ņśżņŚ╝ ņĀ£Ļ▒░ļź╝ ņ¦äĒ¢ēĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņ╣śļŻī Ļ│äĒÜŹņØä ņłśļ”ĮĒĢśņśĆļŗż(
Fig. 5).
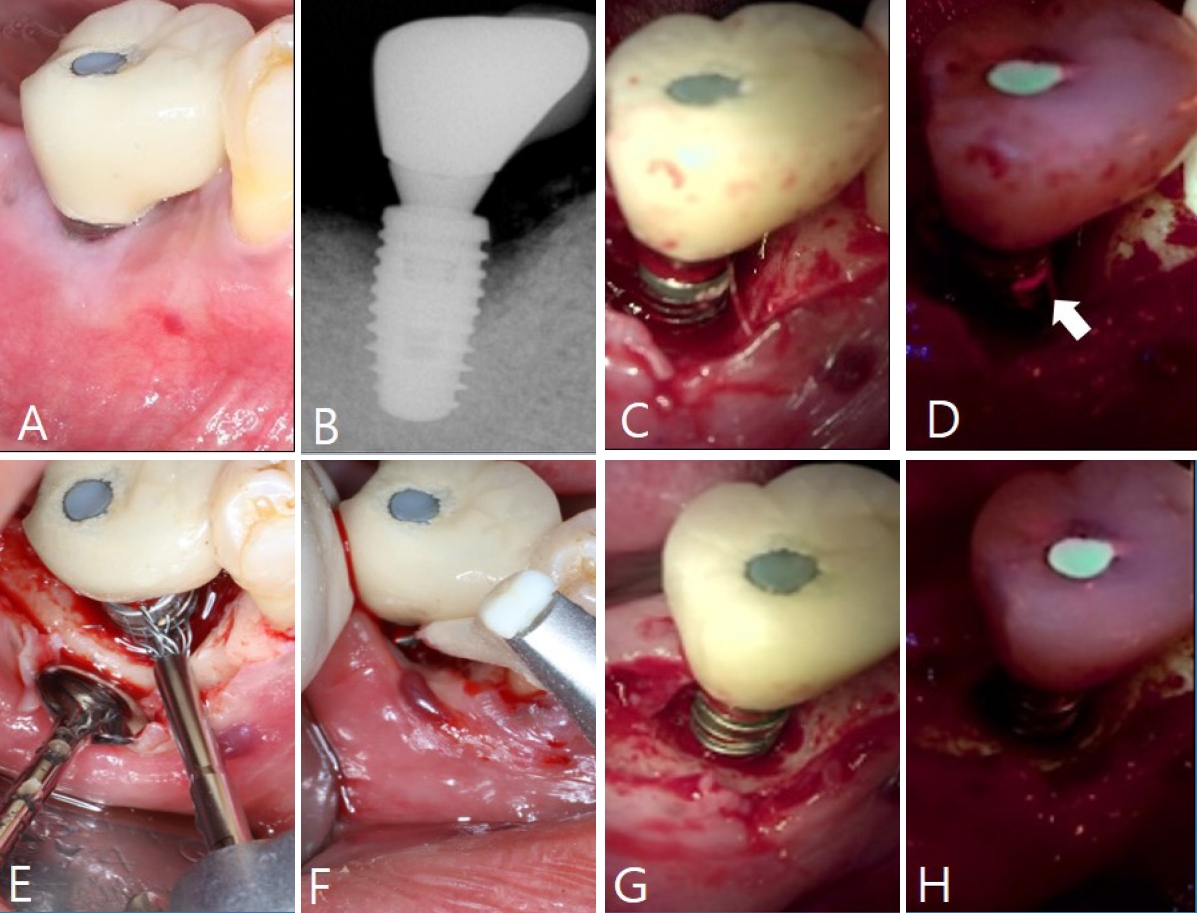
#46 ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņØś ņČ£Ēśł ļ░Å ņŚ╝ņ”Ø ļ░śņØæņØä ĒżĒĢ©ĒĢ£ ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņŚ╝ņØ┤ ņ¦ĆņåŹļÉśņ¢┤, ņ×äĒöīļ×ĆĒŖĖ Ēæ£ļ®┤ņØś ļ│┤ļŗż ņĀüĻĘ╣ņĀüņØĖ ņśżņŚ╝ ņĀ£Ļ▒░ļź╝ ņ£äĒĢ┤ ņĀäņĖĄĒīÉļ¦ē Ļ▒░ņāüņłĀņØä ņŗ£Ē¢ēĒĢśĻĖ░ļĪ£ Ļ▓░ņĀĢĒĢśņśĆļŗż. ņØ┤ļź╝ ņ£äĒĢ┤ #15T blade ļ░Å #12 bladeļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ #45 ņ╣śņĢäņØś ņøÉņŗ¼ ņäĀĻ░ü ļČĆņ£äļČĆĒä░ ņŚ┤ĻĄ¼ļé┤ ņĀłĻ░£ļź╝ ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░, #46 ņ×äĒöīļ×ĆĒŖĖņØś ņøÉņŗ¼ņĖĪ ļ¼┤ņ╣śņĢģ ļČĆņ£äņŚÉļŖö ņ╣śņĪ░ņĀĢ ņĀłĻ░£ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. ņĀäņĖĄĒīÉļ¦ēņØä Ļ▒░ņāüĒĢ£ Ēøä, ņ×äĒöīļ×ĆĒŖĖ Ēæ£ļ®┤ņØś ņśżņŚ╝ ņāüĒā£ļź╝ ļ│┤ļŗż ļ¬ģĒÖĢĒ׳ ĒÅēĻ░ĆĒĢśĻĖ░ ņ£äĒĢ┤ QLF ņ┤¼ņśüņØä ņŗ£Ē¢ēĒĢśņśĆļŗż.
QLF ņśüņāüņØä ĒåĄĒĢ┤ ņ×äĒöīļ×ĆĒŖĖ Ēæ£ļ®┤ņØś ļ░öņØ┤ņśżĒĢäļ”ä ļČäĒżļź╝ ļ¬ģĒÖĢĒ׳ ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłņ£╝ļ®░, ņ£ĪņĢł Ļ▓Ćņé¼ļ│┤ļŗż ļŹöņÜ▒ ņĀĢļ░ĆĒĢśĻ▓ī ņśżņŚ╝ļÉ£ ļČĆņ£äļź╝ ĒÅēĻ░ĆĒĢĀ ņłś ņ׳ņŚłļŗż. ņØ┤ņŚÉ ļö░ļØ╝ ņ▓½ļ▓łņ¦Ė ņ╝ĆņØ┤ņŖżņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ņ×äĒöīļ×ĆĒŖĖ ņĀäņÜ® ņŖżņ╝ĆņØ╝ļ¤¼ Ēīü, NiTi ļĖīļ¤¼ņŗ£ (Ti Brush, Megagen, Daegu, Korea), air-powder abrasive deviceļź╝ ņł£ņä£ļīĆļĪ£ ņé¼ņÜ®ĒĢśņŚ¼ ņ×äĒöīļ×ĆĒŖĖ Ēæ£ļ®┤ņØä ņäĖņĀĢĒĢśņśĆņ£╝ļ®░, ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ĒÅēĻ░ĆĒĢśĻĖ░ ņ£äĒĢ┤ QLFļź╝ ļŗżņŗ£ ņ┤¼ņśüĒĢśņśĆļŗż(
Fig. 6).
ļśÉĒĢ£, ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņŚÉ ĒÖśņāüĒśĢ Ļ│©Ļ▓░ņåÉņØ┤ Ļ┤Ćņ░░ļÉśņ¢┤, #46 ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ļ│Ć Ļ│© Ļ▓░ņåÉ ļČĆņ£äņŚÉ ļÅÖņóģĻ│©ņØ┤ņŗØņ×¼(ICB, irradiated allogenic cancellous bone and marrow, Rocky Mountain Tissue Bank, USA)ņÖĆ ĒØĪņłśņä▒ ņĮ£ļØ╝Ļ▓É ļ®żļĖīļĀłņØĖ(OssMem Soft, Osstem Implant Co., Seoul, Korea)ņØä ņĀüņÜ®ĒĢśņśĆļŗż. ņØ┤Ēøä, 5-0 ĒØĪņłśņä▒ ĒĢ®ņä▒ ļ┤ēĒĢ®ņé¼(Coated VicrylTM, Ethicon, Johnson and Johnson, Somerville, USA)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ Ļ│ĀņĀĢņä▒ ļ┤ēĒĢ®(anchor suture)ņØä ņŗ£Ē¢ēĒĢśĻ│Ā, 5-0 ĒØĪņłśņä▒ ļŗ©ņØ╝ ņä¼ņ£Ā ļ┤ēĒĢ®ņé¼(Monosyn┬«, B. Braun, Tuttlingen, Germany)ļĪ£ ļ│ĆĒśĢ Laurell ļ┤ēĒĢ® ļ░Å ļŗ©ņł£ ļŗ©ņåŹ ļ┤ēĒĢ®ņØä ņŗ£Ē¢ēĒĢśņśĆļŗż(
Fig. 7).
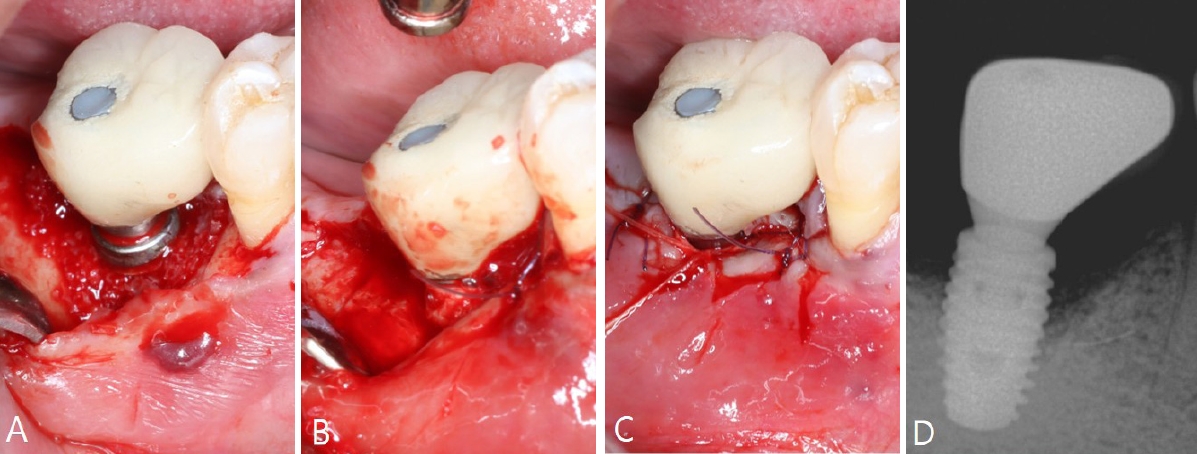
ņ×äĒöīļ×ĆĒŖĖ Ēæ£ļ®┤ ņśżņŚ╝ ņĀ£Ļ▒░ļź╝ ņ£äĒĢ£ ĒīÉļ¦ēņłĀ ņŗ£Ē¢ē 2ņŻ╝ Ēøä, ĒÖśņ×ÉĻ░Ć ļé┤ņøÉĒĢśņŚ¼ ļ┤ēĒĢ®ņé¼ļź╝ ņĀ£Ļ▒░ĒĢśņśĆņ£╝ļ®░, ņ╣śņ£Ā ņāüĒā£ļŖö ņ¢æĒśĖĒĢśņśĆĻ│Ā ļ│äļŗżļźĖ ņØ┤ņāü ņåīĻ▓¼ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ņłśņłĀ 2ļŗ¼ Ēøä Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ņØä ņŗ£Ē¢ēĒĢ£ Ļ▓░Ļ│╝, ņÖĖĻ│╝ņĀü ņ▓śņ╣śļĪ£ ņØĖĒĢ£ ņ╣śņØĆ Ēć┤ņČĢņ£╝ļĪ£ ņØĖĒĢ┤ ņ×äĒöīļ×ĆĒŖĖņØś ĻĖłņåŹ Ēæ£ļ®┤ ņØ╝ļČĆĻ░Ć ĻĄ¼Ļ░Ģ ļé┤ļĪ£ ļģĖņČ£ļÉśņŚłņ£╝ļéś, ĒÖśņ×ÉļŖö ņ×äņāüņĀüņ£╝ļĪ£ ļČłĒÄĖĻ░ÉņØä ĒśĖņåīĒĢśņ¦Ć ņĢŖņĢśļŗż. ļśÉĒĢ£, ņ╣śļŻī ņĀäĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņ×äĒöīļ×ĆĒŖĖ Ēæ£ļ®┤ņØś ņ£äņāØ Ļ┤Ćļ”¼Ļ░Ć Ļ░£ņäĀļÉśņŚłņ£╝ļ®░, ņĀäļ░śņĀüņØĖ ĻĄ¼Ļ░Ģ ņāüĒā£ļÅä ņĢłņĀĢņĀüņØĖ ņ¢æņāüņØä ļ│┤ņśĆļŗż. 5Ļ░£ņøö Ēøä ņ£Āņ¦Ć Ļ┤Ćļ”¼ļź╝ ņ£äĒĢ┤ ĒÖśņ×ÉĻ░Ć ņ×¼ļé┤ņøÉĒĢśņśĆņ£╝ļ®░, ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ļ│Ć ņŚ░ņĪ░ņ¦ü ņāüĒā£ļŖö ņ¢æĒśĖĒĢśņśĆĻ│Ā, ņ×äņāüņĀüņ£╝ļĪ£ ņŚ╝ņ”Ø ņåīĻ▓¼ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ļ░®ņé¼ņäĀņé¼ņ¦äņŚÉņä£ Ļ▓░ņåÉ ļČĆņ£äņŚÉņä£ Ļ│© ĒśĢņä▒ņØ┤ ņ¦äĒ¢ēļÉśļŖö ņ¢æņāüņØ┤ ĒÖĢņØĖļÉśņŚłņ£╝ļ®░, ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ļ│ĆņØś Ļ│© ņāüĒā£ ņŚŁņŗ£ ņĢłņĀĢņĀüņ£╝ļĪ£ ņ£Āņ¦ĆļÉśņŚłĻ│Ā, ļ│äļŗżļźĖ ļ│æņĀü ņåīĻ▓¼ņØĆ ļéśĒāĆļéśņ¦Ć ņĢŖņĢśļŗż(
Fig. 8).
ĒåĀņØś
ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņŚ╝ņØĆ Ļ│©ņåīņŗżņØä ļÅÖļ░śĒĢ£ ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£ä ņĪ░ņ¦üņØś ņŚ╝ņ”Øņ£╝ļĪ£ ņĀĢņØśļÉśļ®░, ņØ╝ļ░śņĀüņ£╝ļĪ£ ļ╣äņäĀĒśĢņĀüņØ┤Ļ│Ā Ļ░ĆņåŹĒÖöļÉśļŖö ņ¦äĒ¢ē Ēī©Ēä┤ņØä ļ│┤ņØ┤ļ®░ ĒåĄņāüņĀüņØĖ ņ╣śņŻ╝ņŚ╝ļ│┤ļŗż ļŹö ļ╣Āļź┤Ļ▓ī ņ¦äĒ¢ēļÉĀ ņłś ņ׳ļŗż. ņŻ╝ļÉ£ ņøÉņØĖņØĆ ļ░öņØ┤ņśżĒĢäļ”äņØś ņČĢņĀüņØ┤ļ®░, ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņŚ╝ņØĆ ņ┤łĻĖ░ ļŗ©Ļ│äņŚÉņä£ ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£ä ņĀÉļ¦ēņŚÉ ĻĄŁĒĢ£ļÉ£ ņŚ╝ņ”ØņØĖ ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£ä ņĀÉļ¦ēņŚ╝ņ£╝ļĪ£ļČĆĒä░ ņŗ£ņ×æļÉ£ļŗż[
3].
ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£ä ņĀÉļ¦ēņŚ╝ņØĆ ņĀüņĀłĒĢ£ ļ░öņØ┤ņśżĒĢäļ”ä ņĪ░ņĀł ņĀäļץņØ┤ ņĀüņÜ®ļÉĀ Ļ▓ĮņÜ░ Ļ░ĆņŚŁņĀüņØ┤ņ¦Ćļ¦ī, ņ╣śļŻīĻ░Ć ņØ┤ļŻ©ņ¢┤ņ¦Ćņ¦Ć ņĢŖņ£╝ļ®┤ ļ╣äĻ░ĆņŚŁņĀüņØĖ Ļ│©ņåīņŗżņØä ļÅÖļ░śĒĢśļŖö ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņŚ╝ņ£╝ļĪ£ ļ░£ņĀäĒĢĀ ņłś ņ׳ļŗż. ļśÉĒĢ£, ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņŚ╝ņØĆ ņ╣śļŻī ĒøäņŚÉļÅä ņ×¼ļ░£ Ļ░ĆļŖźņä▒ņØ┤ ņ׳ņ£╝ļ®░, 5ļģä Ēøä 32-44%ņØś ņ×¼ļ░£ļźĀņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż[
4]. ņØ┤ļŖö ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņŚ╝ņØś ņÖäņ╣śĻ░Ć ņ¢┤ļĀĄĻ│Ā, ņĀĢĻĖ░ņĀüņØĖ ņ£Āņ¦Ć Ļ┤Ćļ”¼ ļ░Å ņĪ░ĻĖ░ ņ¦äļŗ©ņØä ĒåĄĒĢ┤ ņ¦łĒÖśņØś ņ¦äĒ¢ēņØä ļ░®ņ¦ĆĒĢśļŖö Ļ▓āņØ┤ ņżæņÜöĒĢ©ņØä ņŗ£ņé¼ĒĢ£ļŗż.
ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņŚ╝ņØś ņÖäņ╣śĻ░Ć ņ¢┤ļĀżņÜ┤ ņøÉņØĖņØĆ ļŗżņ¢æĒĢśņ¦Ćļ¦ī, ĻĘĖņżæ ĒĢśļéśļŖö ņ×äĒöīļ×ĆĒŖĖ ļéśņé¼ņäĀņŚÉ ļ░öņØ┤ņśżĒĢäļ”äņØ┤ ņēĮĻ▓ī ņ╣©ņ░®ļÉśļ®░ ņĀ£Ļ▒░Ļ░Ć ņ¢┤ļĀĄļŗżļŖö ņĀÉņØ┤ļŗż. ņ×äĒöīļ×ĆĒŖĖ ļéśņé¼ņäĀņØś ņÜöņ▓Ā ĻĄ¼ņĪ░ļŖö ņäĖĻĘĀĻ│╝ ļ░öņØ┤ņśżĒĢäļ”äņØś ļČĆņ░®ņØä ņÜ®ņØ┤ĒĢśĻ▓ī ĒĢśļ®░, ņØ┤ļ¤¼ĒĢ£ ņ╣©ņ░®ļ¼╝ņØä ņĀ£Ļ▒░ĒĢśļŖö Ļ│╝ņĀĢ ļśÉĒĢ£ ņ¢┤ļĀżņøĆņØ┤ ļö░ļźĖļŗż[
12]. ĒŖ╣Ē׳, Ļ╣ŖņØĆ ļČĆņ£äĻ╣īņ¦Ć ĻĖ░ĻĄ¼Ļ░Ć ļÅäļŗ¼ĒĢśĻĖ░ ņ¢┤ļĀżņøī ļ¼╝ļ”¼ņĀü ņäĖņĀĢņØ┤ ņĀ£ĒĢ£ļÉśļ®░, Ēæ£ļ®┤ņØś ļ»ĖņäĖĒĢ£ ņÜöņ▓ĀļĪ£ ņØĖĒĢ┤ ņäĖĻĘĀņØ┤ ņēĮĻ▓ī ļČĆņ░®ĒĢśĻ│Ā ņ×öņĪ┤ĒĢĀ Ļ░ĆļŖźņä▒ņØ┤ ļåÆļŗż[
13].
ņØ┤ņŚÉ ļö░ļØ╝, ņĄ£ĻĘ╝ QLF ĻĖ░ņłĀņØ┤ ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņŚ╝ņØś ņ¦äļŗ©Ļ│╝ ņ╣śļŻī ĒÅēĻ░ĆņŚÉ ņżæņÜöĒĢ£ ļÅäĻĄ¼ļĪ£ ņŻ╝ļ¬®ļ░øĻ│Ā ņ׳ļŗż. QLFļŖö 405 nmņØś ņ▓ŁņāēĻ┤æņØä ņĪ░ņé¼ĒĢśņŚ¼ ņäĖĻĘĀ ļīĆņé¼ ņé░ļ¼╝ņØĖ Ēżļź┤Ēö╝ļ”░ņŚÉņä£ ļ░£ņāØĒĢśļŖö ņĀüņāē ĒśĢĻ┤æņØä Ļ░Éņ¦ĆĒĢ©ņ£╝ļĪ£ņŹ© ļ│æņøÉņä▒ ļ░öņØ┤ņśżĒĢäļ”äņØä ņŗ£Ļ░üņĀüņ£╝ļĪ£ ĒÅēĻ░ĆĒĢĀ ņłś ņ׳ļŗż[
9]. ņØ┤ļź╝ ĒåĄĒĢ┤, ĻĖ░ņĪ┤ ļ░®ļ▓Ģņ£╝ļĪ£ Ļ░Éņ¦ĆļÉśņ¦Ć ņĢŖļŖö ļ»ĖņäĖĒĢ£ ļ░öņØ┤ņśżĒĢäļ”ä ļ░Å ņ┤łĻĖ░ ļ│æļ│ĆņØä ļ│┤ļŗż ļ¬ģĒÖĢĒĢśĻ▓ī ņŗ£Ļ░üņĀüņ£╝ļĪ£ ĒÖĢņØĖĒĢĀ ņłś ņ׳ņ£╝ļ®░, ņ╣śļŻī Ļ│äĒÜŹ ņłśļ”ĮņŚÉļÅä ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢĀ ņłś ņ׳ļŗż[
14].
ļ│Ė ņ”ØļĪĆņŚÉņä£ļŖö QLFļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņŚ╝ņØ┤ ņØśņŗ¼ļÉśļŖö ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņØś ņśżņŚ╝ ņāüĒā£ļź╝ ņ¦äļŗ©ĒĢśĻ│Ā, ņ╣śļŻī ņĀäĒøä ļ│ĆĒÖöļź╝ ĒÅēĻ░ĆĒĢśņśĆļŗż. QLF ņ┤¼ņśüņØä ĒåĄĒĢ┤ ņ£ĪņĢłņ£╝ļĪ£ļŖö ĒÖĢņØĖļÉśņ¦Ć ņĢŖļŹś ļ»ĖņäĖĒĢ£ ļ░öņØ┤ņśżĒĢäļ”äņØä ļ¬ģĒÖĢĒĢśĻ▓ī ņŗ£Ļ░üĒÖöĒĢĀ ņłś ņ׳ņ£╝ļ®░, ņ╣śļŻī Ļ│╝ņĀĢņŚÉņä£ņØś ņäĖņĀĢ ĒÜ©Ļ│╝ļź╝ Ļ░ØĻ┤ĆņĀüņ£╝ļĪ£ ĒÅēĻ░ĆĒĢĀ ņłś ņ׳ņŚłļŗż. ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ļåÆņØ┤ĻĖ░ ņ£äĒĢ┤ ĻĖ░ļ│ĖņĀüņØĖ ņ┤łņØīĒīī ņŖżņ╝ĆņØ╝ļ¤¼ņŚÉ ļŹöĒĢśņŚ¼, NiTi ļĖīļ¤¼ņē¼ņÖĆ air-powder abrasive deviceļź╝ ņČöĻ░ĆņĀüņ£╝ļĪ£ ņé¼ņÜ®ĒĢśņśĆļŗż. ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤, NiTi ļĖīļ¤¼ņē¼ļŖö ņ×äĒöīļ×ĆĒŖĖ ļéśņé¼ņäĀņØś ĒĢ©ļ¬░ ļČĆņ£ä(valley)Ļ╣īņ¦Ć ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņĀæĻĘ╝ĒĢśņŚ¼ ņäĖņĀĢĒĢ©ņ£╝ļĪ£ņŹ© ņ×äĒöīļ×ĆĒŖĖ Ēæ£ļ®┤ņØä ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņäĖņ▓ÖĒĢśĻ│Ā, ĒāÉņ╣© Ļ╣ŖņØ┤ļź╝ Ļ░Éņåīņŗ£ĒéżļŖö ļŹ░ ĻĖ░ņŚ¼ĒĢĀ ņłś ņ׳ļŗż[
15,
16]. ļśÉĒĢ£, air-powder abrasive deviceļŖö ņ×äĒöīļ×ĆĒŖĖ Ēæ£ļ®┤ņØś ņåÉņāüņØä ņĄ£ņåīĒÖöĒĢśļ®┤ņä£ ļ░öņØ┤ņśżĒĢäļ”ä ņĀ£Ļ▒░ ļ░Å ļ»ĖņāØļ¼╝ ĒÖśĻ▓Į Ļ░£ņäĀņØä ĒåĄĒĢ┤ ņČ£ĒśłĻ│╝ ĒÖöļåŹņØä ĒżĒĢ©ĒĢ£ ņŚ╝ņ”Ø ļ░śņØæņØä ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ Ļ░Éņåīņŗ£ĒéżļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[
16-
18].
ņ▓½ ļ▓łņ¦Ė ņ”ØļĪĆļŖö ņć╝ĻĘĖļĀī ņ”ØĒøäĻĄ░ ļ░Å Ļ│©ļŗżĻ│Ąņ”ØņØä ļÅÖļ░śĒĢ£ Ļ│ĀļĀ╣ ĒÖśņ×ÉņØś ņ×äĒöīļ×ĆĒŖĖņŚÉņä£ ņŗ¼Ļ░üĒĢ£ ļ░öņØ┤ņśżĒĢäļ”ä ņČĢņĀüĻ│╝ Ļ│© ņåīņŗżņØä ĒżĒĢ©ĒĢ£ ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņŚ╝ņØ┤ Ļ┤Ćņ░░ļÉ£ ņé¼ļĪĆņØ┤ļŗż. ĒÖśņ×ÉļŖö Ļ│ĀļĀ╣ņ£╝ļĪ£ ņØĖĒĢ┤ ņÖĖĻ│╝ņĀü ņ▓śņ╣śņŚÉ ļīĆĒĢ£ Ļ▒░ļČĆĻ░ÉņØä ļéśĒāĆļé┤ņ¢┤ ļ╣äņÖĖĻ│╝ņĀü ņ╣śļŻī ļ░®ļ▓Ģļ¦īņØä ņĀüņÜ®ĒĢśĻĖ░ļĪ£ Ļ│äĒÜŹĒĢśņśĆļŗż. ļśÉĒĢ£, ĒÖśņ×ÉĻ░Ć ļČłĻĘ£ņ╣ÖĒĢ£ ļé┤ņøÉ ņ¢æņāüņØä ļ│┤ņŚ¼ ņČöĻ░ĆņĀüņØĖ ļÅÖĻĖ░ ļČĆņŚ¼Ļ░Ć ĒĢäņÜöĒĢśņśĆļŗż. ļö░ļØ╝ņä£ ļ░öņØ┤ņśżĒĢäļ”ä ņ╣©ņ░®ņØś ļ▓öņ£äņÖĆ ņŗ¼Ļ░üļÅäļź╝ ļ│┤ļŗż ļ¬ģĒÖĢĒĢśĻ▓ī ĒÅēĻ░ĆĒĢśĻ│Ā ĒÖśņ×ÉņŚÉĻ▓ī Ēśäņ×¼ ņāüĒā£ļź╝ Ļ░üņØĖņŗ£ņ╝£ ļÅÖĻĖ░ ļČĆņŚ¼ļź╝ Ļ░ĢĒÖöĒĢśĻĖ░ ņ£äĒĢśņŚ¼, ĻĖ░ņĪ┤ņØś ņ×äņāüņĀü ļ░Å ļ░®ņé¼ņäĀĒĢÖņĀü ĒÅēĻ░ĆņŚÉ ņČöĻ░ĆņĀüņ£╝ļĪ£ QLF ņ┤¼ņśüņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ņ┤łņØīĒīī ņŖżņ╝ĆņØ╝ļ¤¼ņÖĆ NiTi ļĖīļ¤¼ņē¼, air-powder abrasive deviceļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ļ░öņØ┤ņśżĒĢäļ”äņØä ņĀ£Ļ▒░ĒĢ£ Ēøä, ļŗżņŗ£ QLF ņ┤¼ņśüņØä ņŗ£Ē¢ēĒĢśņŚ¼ ņ╣śļŻī ņĀäĒøäņØś ņ░©ņØ┤ļź╝ ņŗ£Ļ░üĒÖöĒĢśņŚ¼ ļ╣äĻĄÉĒĢśņśĆņ£╝ļ®░, ļ░öņØ┤ņśżĒĢäļ”ä ņ×öņĪ┤ ņŚ¼ļČĆļź╝ ĒÖĢņŗżĒ׳ ĒÖĢņØĖĒĢ©ņ£╝ļĪ£ņŹ© ļ│┤ļŗż ņ▓ĀņĀĆĒĢ£ ņ▓śņ╣śĻ░Ć Ļ░ĆļŖźĒĢśņśĆļŗż.
ļæÉ ļ▓łņ¦Ė ņ”ØļĪĆņŚÉņä£ļÅä QLFļŖö ņ×äĒöīļ×ĆĒŖĖ Ēæ£ļ®┤ņØś ņ×öņĪ┤ ļ░öņØ┤ņśżĒĢäļ”äņØä ņŗ£Ļ░üņĀüņ£╝ļĪ£ ļ¬ģĒÖĢĒĢśĻ▓ī ĒÅēĻ░ĆĒĢśĻ│Ā, ņ▓ĀņĀĆĒĢ£ ņäĖņĀĢņØ┤ ņØ┤ļŻ©ņ¢┤ņĪīņØīņØä Ļ▓Ćņ”ØĒĢśļŖö ļŹ░ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśņśĆļŗż. ņ▓½ ļ▓łņ¦Ė ņ”ØļĪĆņÖĆ ļŗ¼ļ”¼, ņÖĖĻ│╝ņĀü ņ▓śņ╣ś ņżæ ņŗżņŗ£Ļ░äņ£╝ļĪ£ QLFļź╝ ĒÖ£ņÜ®ĒĢśņŚ¼ ņ×äĒöīļ×ĆĒŖĖ Ēæ£ļ®┤ņØś ņäĖņĀĢ ņāüĒā£ļź╝ ĒÅēĻ░ĆĒĢśņśĆļŗż. ĻĖ░ņĪ┤ņØś ņ£ĪņĢł ĒÅēĻ░Ćļéś ļ░®ņé¼ņäĀ ņé¼ņ¦äļ¦īņ£╝ļĪ£ļŖö ņ×öņĪ┤ ļ░öņØ┤ņśżĒĢäļ”äņØä ņĀĢĒÖĢĒ׳ ĒÖĢņØĖĒĢśĻĖ░ ņ¢┤ļĀżņÜ┤ Ļ▓ĮņÜ░Ļ░Ć ļ¦Äņ¦Ćļ¦ī, QLFļź╝ ĒåĄĒĢ┤ ņśżņŚ╝ ņāüĒā£ļź╝ ļ¬ģĒÖĢĒĢśĻ▓ī ņŗ£Ļ░üĒÖöĒĢĀ ņłś ņ׳ņŚłņ£╝ļ®░, ļ│┤ļŗż ļ®┤ļ░ĆĒĢ£ ņ×äĒöīļ×ĆĒŖĖ Ēæ£ļ®┤ ņäĖņĀĢņØ┤ Ļ░ĆļŖźĒĢśņśĆļŗż. QLF ņ┤¼ņśüņØä ĒåĄĒĢ┤ ņäĖņĀĢņØ┤ ņÖäļŻīļÉ£ ņ×äĒöīļ×ĆĒŖĖ Ēæ£ļ®┤ņØä ļČäņäØĒĢ£ Ļ▓░Ļ│╝, ņČöĻ░ĆņĀüņØĖ ļ░öņØ┤ņśżĒĢäļ”äņØ┤ ļé©ņĢä ņ׳ņ¦Ć ņĢŖņØīņØä Ļ░ØĻ┤ĆņĀüņ£╝ļĪ£ ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłņ£╝ļ®░, ņØ┤ļŖö ņ╣śļŻī Ēøä ņ×öņĪ┤ ņśżņŚ╝ļ¼╝ņŚÉ ļīĆĒĢ£ ļČłĒÖĢņŗżņä▒ņØä ņżäņØ┤ļŖö ļŹ░ ĻĖ░ņŚ¼ĒĢśņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ ņ▓ĀņĀĆĒĢ£ ļ░öņØ┤ņśżĒĢäļ”ä ņĀ£Ļ▒░ļź╝ ĒåĄĒĢ┤ Ļ░ÉņŚ╝ ņ£äĒŚśņØä ņĄ£ņåīĒÖöĒĢśĻ│Ā ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£ä ĒÖśĻ▓ĮņØä Ļ░£ņäĀĒĢ©ņ£╝ļĪ£ņŹ©, Ļ▓░ņåÉ ļČĆņ£äņØś Ļ│© ĒśĢņä▒ņØä ņ┤ēņ¦äĒĢśņŚ¼ ņ¢æĒśĖĒĢ£ ņ×äņāüņĀü Ļ▓░Ļ│╝ļź╝ ņ¢╗ņØä ņłś ņ׳ņŚłļŗż.
ņ”ØļĪĆ 1Ļ│╝ 2 ļ¬©ļæÉ ĒÖśņ×ÉņØś ņĀäņŗĀ Ļ▒┤Ļ░Ģ ņāüĒā£ ļ░Å ņ¦Ćļ”¼ņĀü ņÜöņØĖņ£╝ļĪ£ ņØĖĒĢ┤ ņ¦ĆņåŹņĀüņØĖ Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ņØ┤ ņØ┤ļŻ©ņ¢┤ņ¦Ćņ¦Ć ļ¬╗ĒĢ£ ĒĢ£Ļ│äĻ░Ć ņ׳ņŚłņ£╝ļéś, ņ¦¦ņØĆ Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ĻĖ░Ļ░ä ļé┤ņŚÉņä£ QLFļź╝ ĒÖ£ņÜ®ĒĢ£ ņ×äĒöīļ×ĆĒŖĖ ņ£Āņ¦Ć Ļ┤Ćļ”¼Ļ░Ć ĒÜ©Ļ│╝ņĀüņØ┤ņŚłņØīņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ņ▓½ ļ▓łņ¦Ė ņ”ØļĪĆņŚÉņä£ļŖö ļ╣äņÖĖĻ│╝ņĀü ņ▓śņ╣śņŚÉ QLFļź╝ ņĀüņÜ®ĒĢśņśĆĻ│Ā, ļæÉ ļ▓łņ¦Ė ņ”ØļĪĆņŚÉņä£ļŖö ņÖĖĻ│╝ņĀü ņ▓śņ╣śņŚÉ QLFļź╝ ņĀüņÜ®Ē¢łļŗżļŖö ņ░©ņØ┤Ļ░Ć ņ׳ņŚłņ¦Ćļ¦ł, ļæÉ ņ”ØļĪĆ ļ¬©ļæÉņŚÉņä£ ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ļ│Ć ļ░öņØ┤ņśżĒĢäļ”äņØś ļ¬ģĒÖĢĒĢ£ ĒÖĢņØĖĻ│╝ ĒÜ©Ļ│╝ņĀüņØĖ ņ▓śņ╣śļź╝ Ļ░ĆļŖźĒĢśĻ▓ī ĒĢśņśĆļŗż. ļśÉĒĢ£, ĒÖśņ×ÉņŚÉĻ▓ī Ēśäņ×¼ ņāüĒā£ļź╝ ņŗ£Ļ░üņĀüņ£╝ļĪ£ ļ¬ģĒÖĢĒĢśĻ▓ī ņØĖņŗØņŗ£Ēé┤ņ£╝ļĪ£ņŹ© ņ×äĒöīļ×ĆĒŖĖ ņ£Āņ¦ĆņÖĆ ĻĄ¼Ļ░Ģ ņ£äņāØ Ļ┤Ćļ”¼ņŚÉ ĻĖŹņĀĢņĀüņØĖ ņśüĒ¢źņØä ļ»Ėņ│żņ£╝ļ®░, ļÅÖĻĖ░ ļČĆņŚ¼ļź╝ Ļ░ĢĒÖöĒĢśļŖö ĒÜ©Ļ│╝Ļ░Ć ņ׳ņŚłļŗż. ļö░ļØ╝ņä£ ļ│Ė ņ”ØļĪĆļź╝ ĒåĄĒĢ┤ QLFĻ░Ć ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņŚ╝ņØś ņ¦äļŗ©Ļ│╝ ņ╣śļŻīņŚÉ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ĒÖ£ņÜ®ļÉĀ ņłś ņ׳ņØīņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłņ£╝ļ®░, Ē¢źĒøä ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ│┤ļŗż ņןĻĖ░ņĀüņØĖ Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ņØä ĒåĄĒĢ┤ ĻĘĖ ņ×äņāüņĀü ņ£ĀĒÜ©ņä▒ņØä ĒÅēĻ░ĆĒĢśļŖö Ļ▓āņØ┤ ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż.
ļ│Ė ņ”ØļĪĆņŚÉņä£ļŖö ņ×äĒöīļ×ĆĒŖĖ ņŻ╝ņ£äņŚ╝ ņ╣śļŻīņŚÉņä£ QLFļź╝ ļ│┤ņĪ░ņĀü ĒÅēĻ░Ć ļÅäĻĄ¼ļĪ£ ĒÖ£ņÜ®ĒĢśņśĆļŗż. ņ╣śļŻī ņĀä QLFļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ×äĒöīļ×ĆĒŖĖ Ēæ£ļ®┤ņŚÉ ņ╣©ņ░®ļÉ£ ņäĖĻĘĀņØä ņŗ£Ļ░üĒÖöĒĢ©ņ£╝ļĪ£ņŹ©, ļ│æļ│Ć ņāüĒā£ļź╝ ļ│┤ļŗż ļ®┤ļ░ĆĒĢśĻ▓ī ĒÅēĻ░ĆĒĢĀ ņłś ņ׳ņŚłļŗż. ļśÉĒĢ£, ņ╣śļŻī Ēøä ņ×äĒöīļ×ĆĒŖĖ Ēæ£ļ®┤ņØä QLFļĪ£ ņ×¼ņ┤¼ņśüĒĢśņŚ¼ ņ×öņĪ┤ ļ░öņØ┤ņśżĒĢäļ”ä ņŚ¼ļČĆļź╝ ĒÖĢņØĖĒĢ©ņ£╝ļĪ£ņŹ©, ļ│┤ļŗż ņ▓ĀņĀĆĒĢ£ Ēæ£ļ®┤ ņäĖņĀĢņØ┤ Ļ░ĆļŖźĒĢśņśĆļŗż. ņ×äņāüņØśļŖö ņ¦äļŗ© ļ░Å ņ╣śļŻī ņŗ£ QLFļź╝ ļ│┤ņĪ░ņĀü ļÅäĻĄ¼ļĪ£ ĒÖ£ņÜ®ĒĢ©ņ£╝ļĪ£ņŹ© Ēśäņ×¼ ņāüĒā£ļź╝ ļ│┤ļŗż ļ¬ģĒÖĢĒĢśĻ▓ī ĒīīņĢģĒĢĀ ņłś ņ׳ņ£╝ļ®░, ņØ┤ļź╝ ĒåĄĒĢ┤ ļŹöņÜ▒ ņäĖņŗ¼ĒĢ£ ņ▓śņ╣śļź╝ ņ¦äĒ¢ēĒĢśņŚ¼ ļ│┤ļŗż ņ¢æĒśĖĒĢ£ ņ╣śļŻī Ļ▓░Ļ│╝ļź╝ ņ¢╗ņØä ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż.













 PDF Links
PDF Links PubReader
PubReader Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print