우식상아질에 적용된 Silver Diamine Fluoride와 Potassium Iodide 용액이 항우식성, 표면경도 그리고 RMGI 결합강도에 미치는 영향
Effects of Silver Diamine Fluoride and Potassium Iodide Solutions on the Anti-Caries Properties, Surface Hardness, and Bond Strength of Resin Modified Glass Ionomer in Dentin
Article information
Trans Abstract
This study evaluated the effects of silver diamine fluoride (SDF) and potassium iodide (PI) on carious dentin. The antibacterial efficacy, surface hardness, and bond strength of resin-modified glass ionomer cement (RMGI) were assessed. Dentin specimens were prepared and subjected to artificial caries formation. The antibacterial effect of SDF/PI was compared to sodium fluoride varnish using Streptococcus mutans colony counts. Surface microhardness was measured using the Vickers hardness test. Shear bond strength of RMGI to treated surfaces was evaluated after thermocycling. Results showed that SDF/PI had superior antibacterial effects compared to NaF varnish. Surface hardness significantly increased one week after SDF/PI application. While SDF/PI treatment did not immediately affect RMGI bond strength to carious dentin, delayed bonding after one week significantly improved bond strength. These findings suggest that SDF/PI is effective in arresting caries and enhancing remineralization of carious dentin. The study also indicates that delaying restoration placement for one week after SDF/PI application may be beneficial for improving bond strength. This research provides valuable insights into the clinical application of SDF/PI for caries management and subsequent restorative procedures.
I. 서론
치아 우식증은 전 세계적으로 가장 흔한 만성 질환 중 하나로 개인의 삶의 질과 공중 보건에 상당한 영향을 미치고 있다[1]. 이러한 맥락에서 Silver Diamine Fluoride(SDF)가 "caries silver-fluoride bullet"이라 불릴 만큼 치아우식증 관리에 있어 새로운 접근법으로 주목받고 있다[2,3].
SDF의 임상 적용은 1960년대 일본에서 시작되었던 바 있다. 일본 오사카 대학의 Nishino 등(1969) [4]등이 치아우식증의 예방과 치료를 위해 38% SDF 용액을 개발하였고, 이는 일본에서 최초의 SDF 제품인 Saforide®(Bee Brand Medico Dental Co, Ltd)의 승인으로 이어졌다[5,6].
SDF는 항균효과를 담당하는 24~28%(w/v)의 은 화합물(농도 253,870 ppm)과 재광화효과를 갖는 5~6%(w/v)의 불소 이온(농도 44,800 ppm), 그리고 농도안정화를 위한 약 8%의 암모니아로 구성되어 있다[2,7]. SDF의 은이 가진 항균 효과는 여러 메커니즘을 통해 이루어진다. 세균 사멸시키고 바이오필름 형성을 억제하며, 죽은 세균이 주변 환경에 은을 재방출하는 "좀비 효과"로 SDF를 재활성화시켜 살아있는 세균을 표적으로 삼는다[8]. SDF에 포함된 불소는 치아의 칼슘 및 인산염과 반응하여 불화수산화인회석을 형성한다. 또한 SDF의 알칼리성은 산성을 중화시켜 기질금속단백분해효소(MMPs, Matrix Metalloproteinases) 같은 유기 기질을 파괴하는 효소를 비활성화하고 재광화를 촉진한다[9].
비록 SDF가 타액 생물막과 치아 법랑질에 대해 유효한 항미생물 효과를 보인다는 것이 밝혀졌으나[10], SDF의 가장 흔히 보고되는 부작용은 변색으로 치아를 검은색 또는 짙은 갈색으로 변화시킨다. 이러한 변색 문제는 SDF 적용 직후 요드화 칼륨(PI, Potassium Iodide)을 도포함으로써 해결할 수 있다고 알려져 있다. PI 염은 남아있는 은 이온과 반응하여 인산은의 형성을 방지하고 변색을 예방한다[11]. 하지만 일부 연구에서는 PI가 은 이온의 수를 줄임으로써 SDF의 항균 효과를 감소시킨다는 결과도 있다[12].
SDF의 임상적 효능은 다양하지만, 그 효과와 관련된 몇 가지 중요한 질문들이 여전히 남아있다. 첫째, SDF와 PI의 조합이 기존의 불소 바니쉬와 비교하여 어떤 항균 효과를 나타내는지에 대한 직접적인 비교 연구가 부족하다. 둘째, SDF/PI 처리가 인공 우식 상아질의 표면 경도에 미치는 영향에 대한 연구가 제한적이다. 마지막으로, SDF/PI 처리 후 수복 재료의 결합 강도에 대한 연구 결과가 일관되지 않다[13,14].
따라서 본 연구의 목적은 다음과 같다:
1. 38% SDF와 PI의 인공 상아질 우식에 대한 항균 효과를 5% 불화나트륨(NaF, Sodium Fluoride) 바니쉬와 비교 평가한다.
2. SDF/PI가 인공 상아질 우식의 표면 경도에 미치는 영향을 평가한다.
3. SDF 처리된 탈회 상아질에 대한 레진강화형 글래스아이오노머(RMGI, Resin modified glass ionomer) 의 전단 결합 강도(SBS, Shear Bond Strength)에 있어 즉시 및 지연 부하 시간의 효과를 평가한다.
이를 위해 본 연구에서는 Streptococcus mutans를 이용한 인공 우식 모델, Vickers 미세경도 측정, 그리고 전단 결합 강도 테스트를 실시하였으며, 이러한 접근을 통해 SDF/PI의 효과와 임상적 적용에 대한 이해를 얻고자 했다.
II. 재료 및 방법
본 연구는 헬싱키 선언의 지침에 따라 수행되었으며, 단국대학교 치과병원 기관생명윤리위원회(IRB)의 승인을 받았다(승인번호: DKUDH IRB 2023-06-004).
1. 항균 효과
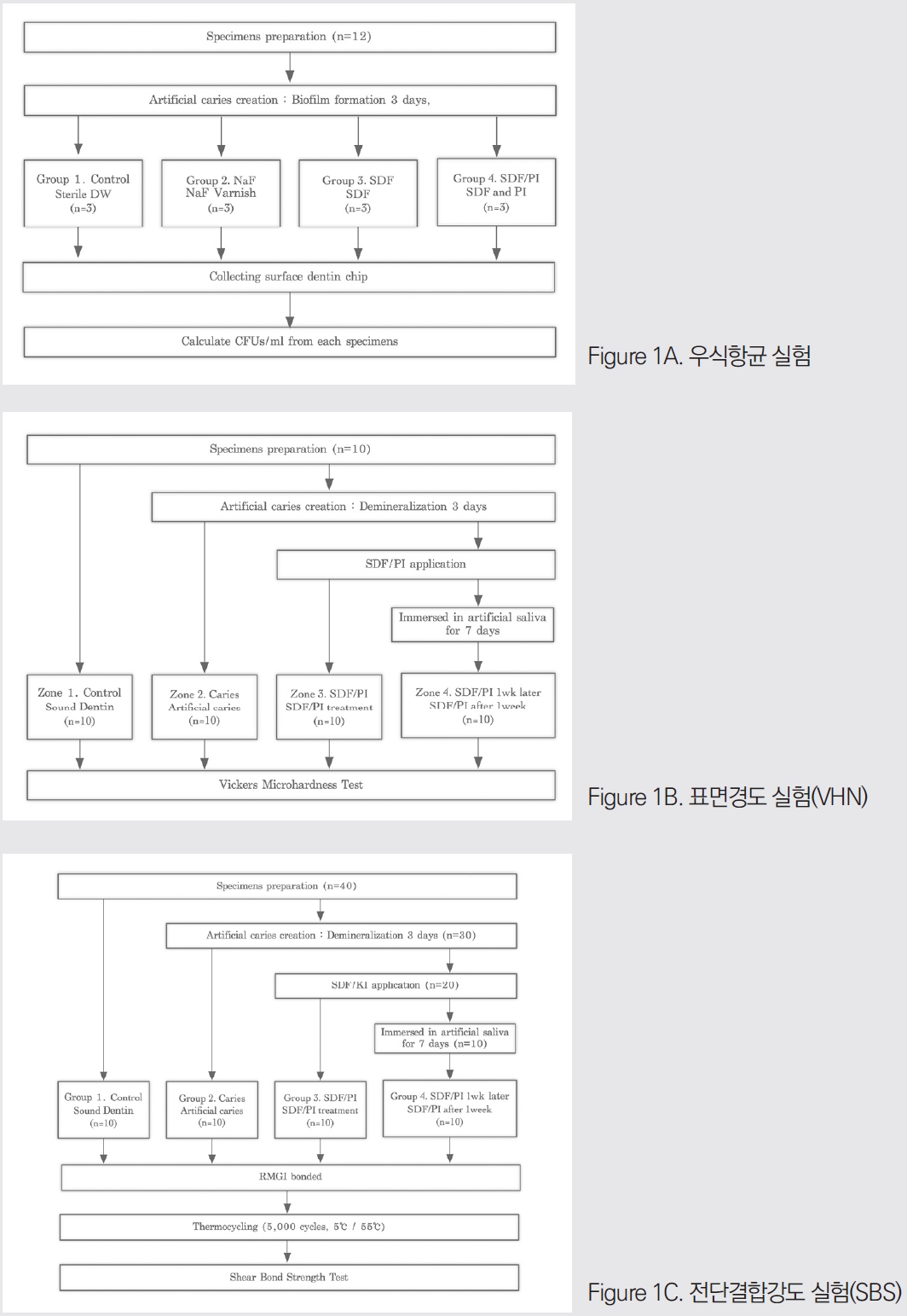
건전한 영구대구치를 이용하여 12개의 상아질 블록(5 x 5 x 5mm³)을 준비하였다. 상아질 시편은 아크릴릭레진(Ortho-jet, Lang Dental Mfg., Wheeling, IL, USA)에 매립하여 상아질 시편의 오직 한 단면만이 노출되도록 하였다. 표면은 200, 400, 600git의 실리콘 카바이드 사포로 연마하여 표준화된 도말층을 생성하였다. 모든 시편은 멸균 후, 인공 상아질 우식을 만들기 위해 Streptococcus mutans(ATCC 25175) 균주를 37℃에서 1.5%(w/v) 한천을 포함한 BHI(Brain Heart Infusion) 배지에서 배양하였다. 바이오필름 형성을 위해, 하룻밤 배양한 균주를 5% 자당을 포함한 BHI배지에 1:100으로 희석하였다. 상아질 블록이 들어있는 6-well 플레이트의 각 well에 1 mL의 박테리아 배양액을 접종한 후, 37℃에서 72시간 동안 배양하였다. 상아질 블록에 결합하지 않은 세포를 세척한 후, 상아질 블록을 상아질 표면 처리 방법에 따라 무작위로 4개 그룹으로 나누었다(Fig. 1A).
그룹 1 : Sterilized deionized water(대조군)
그룹 2 : 5% Sodium Fluoride Varmish(Clinpro, 3M ESPE, St Paul, MN, USA)
그룹 3 : 38% Sodium Diamine Fluoride(Riva star, SDI, Bayswater, Australia)
그룹 4 : Potassium Iodide after 38% SDF(Riva star, SDI, Bayswater, Australia)
모든 블록은 구강 환경을 모방하기 위해 Macknight-Hane와 Whitford가 1992년에 발표한 방법에 따라 제조한 인공타액에 37℃, 1시간 동안 침전시켰다. 이후 저속 컨트라앵글 핸드피스에 장착된 멸균 라운드 버를 사용하여 상아질 칩을 수집하였다. 상아질 칩은 BHI 배지(1mL)에 균질화 하였으며, 이렇게 형성된 세균 혼탁액을 BHI 배양액을 이용하여 10~104배로 연속희석하였다. 각각 희석된 세균 혼탁액을 BHI 한천 플레이트에 도말 후 37℃에서 2일간 배양 후 집락형성단위(CFU, colony forming unit)를 측정하였다. 위와 같은 항균 효과 테스트를 통해 총 3회의 독립적인 실험으로 반복하였다.
2. 표면 경도
표면 경도 평가를 위해 10개의 건전한 영구대구치 치아 시편을 사용하였다. 교합면의 법랑질을 흐르는 물 아래에서 모델 트리머로 제거한 후 치아를 원형 플라스틱 몰드를 통헤 아크릴릭레진(Ortho-jet, Lang Dental Mfg., Wheeling, IL, USA)으로 매립하였다. 표면은 200, 400, 600 그릿의 실리콘 카바이드 사포로 연마하여 표준화된 도말층을 생성하였다. 각 시편은 단일 시편 내에서 4단계 순서로 진행하는 표면 처리 구역으로 분할하였다(Fig. 1B).
구역 1 : 건전 상아질 표면 도말층 형성 후, 표면경도 측정.
구역 2 : 인공우식을 통한 탈회 후, 표면경도 측정.
구역 3 : SDF및 PI 적용 후, 표면경도 측정.
구역 4 : SDF와 PI 적용 1주일 후, 표면경도 측정.
비커스 경도(VHN, Vickers Hardness Number)는 비커스 미세경도 시험기(HM-211, Mitutoyo, Kanagawa, Japan)를 사용하여 피라미드형 다이아몬드 압입기를 통해 실온에서 10초 동안 200g의 하중을 가해 측정하였다. VHN은 각 상아질 표면 구역 내에서 3회 측정하여 각 샘플의 평균 미세경도 값을 계산하였다.
3. 전단 결합 강도
전단 결합 강도 평가를 위해 40개의 시편을 사용하였다. 시편은 VHN 테스트와 동일한 방법으로 준비하고 무작위로 4개의 하위 그룹으로 배정하였다(Fig. 1C)
그룹 1 : 건전 상아질 표면, 대조군(n=10)
그룹 2 : 인공우식이 재현된 상아질 표면(n=10)
그룹 3 : 인공우식이 재현된 표면에, SDF및 PI 처리(n=10)
그룹 4 : 인공우식이 재현된 표면에, SDF및 PI 처리 1 주일 후(n=10)
각 시편을 본딩 클램프(UltraTester, Ultradent Products, Inc., Utah, USA)에 고정한 후, RMGI를 본딩 몰드 인서트(UltraTester, Ultradent Products, INC., Utah, USA)를 사용하여 채웠다. RMGI를 충전하기 전, 상아질 컨디셔너로 표면 전처리를 수행하였다.
중합 후, 시편을 몰드에서 조심스럽게 제거하고 열순환기에서 5℃ 및 55℃ 간 열순환 처리를 5000회 수행하였다. 그 후 시편을 전단 결합 강도 시험기(Shear Bond Tester, Bisco, Illinois, USA)에 장착하고, 접착 실패가 발생할 때까지 0.5 mm/분의 속도로 전단력을 가해 전단결합강도를 측정하였다.
4. 통계 분석
항균 실험의 모든 데이터는 SAS 프로그램(SAS software, SAS Institute Inc., Cary, NC, USA)을 사용하여 Student's ttest로 분석하였다. 비커스 미세경도 및 전단 결합 강도 테스트 데이터는 IBM SPSS statistics 21.0(IBM corp, New York, USA)을 사용하여 통계적으로 분석하였다. 비커스 미세경도 테스트와 전단 결합 강도 테스트는 일원배치 분산분석과 사후 Tukey 검정을 사용하였다. 유의수준은 5%로 하였다 .
III. 결과
1. 항균 효과
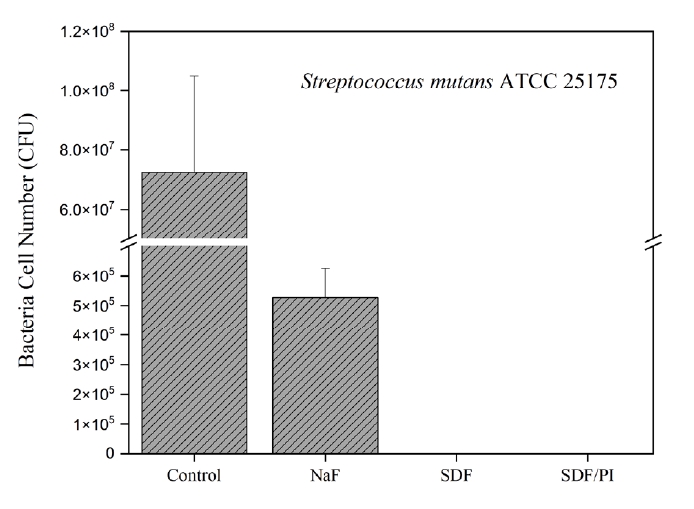
Fig. 2는 Streptococcus mutans의 CFU 평균값과 표준편차를 보여준다. SDF+PI, SDF, NaF 그룹에서 대조군에 비해 유의한 감소가 관찰되었다(p<0.05). SDF 그룹은 PI 용액 사용 여부를 떠나, NaF 그룹보다 우수한 항균 효과를 나타냈다(p<0.05).
2. 표면 경도
탈회 후와 SDF/PI 적용 직후의 VHN에는 유의한 차이가 없었다(Fig. 3). 그러나 SDF/PI 적용 1주일 후에는 VHN이 유의하게 증가하였다(p<0.05).
3. 전단 결합 강도
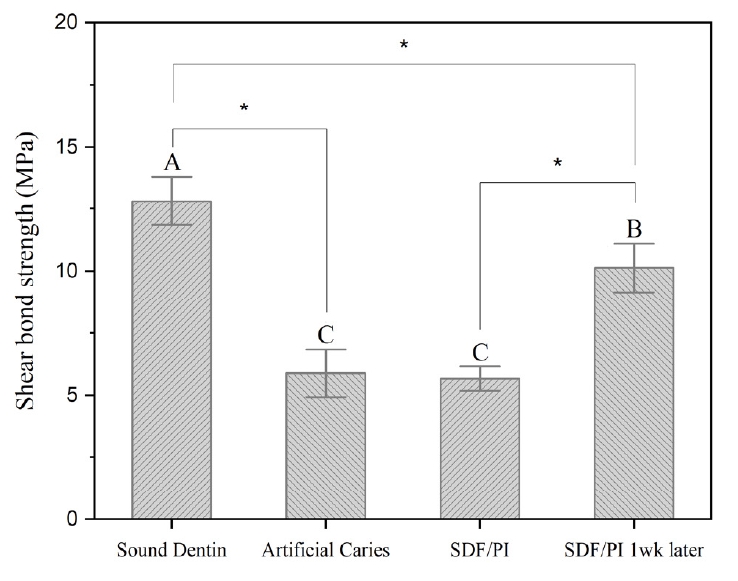
인공 우식 상아질 표면의 수복 재료에 대한 결합 강도는 건전 상아질에 비해 유의하게 낮았다(Fig. 4). 인공 우식에 SDF/PI를 적용한 후, RMGI는 유사한 결합 강도를 보였다. SDF/PI 처리 후, 즉시 수복에 비해 1주일 후 지연 접착한 군이 더욱 높은 결합 강도가 관찰할 수 있었다(p<0.05).
IV. 고찰
SDF는 중국, 일본, 독일, 네팔, 브라질, 아르헨티나, 뉴질랜드, 호주 등 여러 국가에서 활용되고 있다[15]. 호주에서는 1984년부터 SDF가 치과 임상에 도입되었으며[16], 브라질도 1980년대 후반부터 SDF의 사용이 보고되었다[17]. 중국에서는 2002년부터 SDF를 이용한 치아 우식 예방 프로그램이 시작되었으며, 이후 수많은 임상 시험을 통해 SDF의 우식 정지 효과를 확인한 바 있다[18]. 2014년 미국 식품의약국(Food and Drug Administration, FDA)은 SDF를 지각과민증 치료를 위한 의료기기로 승인하였으나[19], 치아우식증 치료에 대한 사용은 FDA 승인을 받지 않은 허가외사용(off-label use) 상태였다. 2016년 미국에서 CDT(Current Dental Terminology) code D1354가 승인되면서 치과의사들이 SDF를 치아 우식증 치료에 사용한 사실을 문서화하고, 이를 보험 청구에 포함할 수 있게 되었다. 이 코드의 승인으로 SDF를 사용한 치료를 보다 체계적으로 기록하고, 환자의 우식증 진행을 억제하는 치료를 명확하게 청구할 수 있는 기반이 마련됨에 따라, 2018년 미국치과의사협회(American Dental Association, ADA)는 우식 병소의 정지를 위한 적절한 치료 옵션으로 SDF의 체계적인 사용을 권장하기에 이르렀다[20]. 2020년에는 대한민국에서도 사용이 승인되어 우식 조절에 SDF 사용에 대한 기대가 높아지고 있다[21].
SDF의 임상적 적응증은 다양하지만 특히, 와동이 형성된 우식 치아와 치근 표면 우식의 정지를 위해 38% SDF 용액이 추천되고 있다[22]. 구강건조증이나 유아기 중증 우식증 등 극심한 우식의 위험이 있는 환자, 행동조절이 어려운 소아 및 장애가 있어 한번의 방문으로 모든 치료가 어려운 환자, 그리고 발치 직전의 치근 우식처럼 치료가 고민스러운 위치의 우식 병변을 갖는 어르신 환자, 치과 치료에 접근이 어려운 환자들이 치료가 대상이 될 수 있다[20].
본 연구에 사용된 NaF 바니쉬와 SDF와 같은 국소 불소제는 재광화 및 항균 효과를 기대하며 예방적 처치제으로 사용되며[23], 미국치과의사협회는 ICDAS(International Caries Detection and Assessment System) 1~2 수준의 표면우식에는 불소 바니쉬를 ICDAS 5~6 수준의 와동이 형성된 우식이나 치근우식에는 SDF를 도포하도록 권장하고 있다[20]. 일반적으로 사용되는 5% NaF 바니쉬는 22,600ppm의 불소를 포함하는 반면, 38% SDF는 44,800ppm의 불소를 포함한다. 본 연구에서 SDF 및 SDF/PI 그룹이 NaF 그룹보다 더 강한 항균 효과를 보였는데, 이를 높은 불소 농도로 이해할 수 있으나 NaF의 우식 억제 및 항균 효과는 일시적이며, SDF의 항균 효과는 주로 은 이온에 의한 것으로 알려져 있다[9]. 38% SDF 용액은 약 253,870ppm의 은 이온을 포함하며[7], 은 이온은 다음과 같은 메커니즘을 통해 항균 효과를 나타낸다. 첫째, 박테리아의 전자 전달 시스템을 억제하고 박테리아 생존에 필수적인 효소의 티올 그룹에 결합하여 효소 기능을 방해한다[24,25]. 둘째, 박테리아 세포막의 음전하 영역과 상호 작용하여 정전기 균형을 방해하고 박테리아의 움직임을 저해하며 세포막을 손상시킨다[26]. 셋째, 박테리아 DNA에 결합하여 DNA 변이와 세포 사멸을 유도한다[25]. 이러한 다중 메커니즘으로 인해 박테리아는 은 이온에 대한 내성을 발달시키기 어렵다. 또한, 은 이온은 상아질 내의 죽은 박테리아에 저장되어 있다가 살아있는 박테리아가 도입되면 재활성화되고 지속적인 항균 효과를 나타낸다[8,9]. 따라서 SDF는 NaF와 같은 불소 기반한 바니쉬에 비해 우수한 항균 효과를 보이며 치아 우식의 예방과 억제에 더욱 효과적으로 사용될 수 있다. 한편, SDF 사용의 가장 일반적으로 보고되는 부작용은 우식 병소의 검은 착색이다. 이는 SDF가 치아에 적용될 때 인산은을 형성하기 때문이다[27]. 이 착색 문제를 SDF 사용 후 PI를 적용함으로써 해결할 수 있다. PI와의 반응으로 인산은이 백색 분말인 삼인산칼륨으로 변하여 변색을 줄이는 역할을 한다[27]. 일부 연구에서는 PI가 은 이온의 수를 줄임으로써 SDF의 항우식 효과를 감소시킨다고 보고하였다[12,28]. 그러나 본 연구 결과에 따르면, SDF를 PI와 함께 사용하더라도 NaF보다 우월한 항균 효과를 나타내며 효과적으로 박테리아를 제거하는 것을 관찰할 수 있었다. 이는 Sorkhdini 등(2021) [29]의 연구 결과와 일치한다.
탈회된 상아질의 경도는 SDF/PI 적용으로 증가하였으며, 1주일 동안 인공 타액에 노출된 후 유의한 증가가 관찰되었다. 우식 병소 표면에서 관찰된 표면경도의 증가는 재광화 효과를 반영한다. 이러한 결과는 SDF가 우식 상아질에서 재광화를 촉진했음을 시사하며, 이는 Chu와 Lo(2008) [30], Mei 등(2013) [31]의 선행연구와 일치한다. 상아질 미세경도의 변화는 그 미네랄 함량과 직접적인 관련이 있다[32,33]. 상아질 내의 미네랄 함량은 박테리아 산의 침투를 제한하는 장벽 역할을 하며, 그 완충 능력은 치아에 침투하는 산을 중화하는 역할을 한다[34]. SDF의 적용은 불소의 존재로 인해 미네랄 함량을 증가시킨다. 수산화인회석의 수산기가 불소로 대체되어 형성되는 불화인회석은 화학적으로 매우 안정적이며 산에 대한 저항성이 증가한다. SDF는 알칼리성이며, 그 높은 알칼리성은 이온 교환에 이상적인 조건을 만들어 표면 불화인회석의 형성을 촉진한다[2,31]. 특히, Mei 등(2013) [31]은 표면층의 칼슘과 인 함량은 우식의 영향을 받지 않은 내부 상아질보다 더 높았음을 확인하였으며, SDF에 의해 유도된 정지된 우식 병소는 활성 우식 병소에 비해 잘 조직화된 결정 구조층을 관찰하였다. Yu 등(2018) [35]도 SDF의 사용이 광화된 표면의 XRD 패턴에서 불용성 염화은이 형성되었다고 보고했다. SDF에 의해 변화된 감염상아질의 표면 구조는 보호 층 역할을 하며 탈회된 상아질에서 칼슘과 인의 추가 손실을 방지한다[30].
본 연구는 RMGI의 상아질표면 접착의 임상 조건을 재현하기 위해 몇가지 노력을 기울였다. 첫째, SDF로 처리한 탈회 상아질 시편을 7일 동안 인공 타액에 침전시켰다. 둘째, 결합 내구성을 평가하기 위해 열순환 과정을 수행했다. 현실적인 결합 강도의 내구성을 실험실 상에서 평가하기 위한 가장 일반적인 방법은 열순환처리 또는 장기수중 보관이다. 이중 열순환은 결합 강도 연구에서 열 피로를 시뮬레이션하기 위해 일반적으로 사용되는데[36], 본 연구에서는 모든 시편을 5000회 열순환하였으며, 이는 약 6개월의 임상 조건을 의미한다[37,38]. 본 연구에서 우식상아질 표면과 SDF/PI를 처리한 우식 상아질 표면에 접착한 RMGI의 결합 강도에는 유의한 차이가 없었는데, 이는 폴리알케노산 체인의 음이온과 수산화인회석의 칼슘 이온 사이의 화학적 결합[39~41]과 상아질 결합제와 상아질 사이에 일어나는 것과 유사한 미세기계적 결합[42~45]이 SDF/PI를 처리한 표면 접착에 중요한 역할을 수행하고 있음을 시사한다[41,46]. 흥미롭게도, SDF/PI 적용 1주일 후 RMGI를 접착한 군의 결합 강도는 유의성 있게 증가하였다. Ng 등(2020) [47]은 SDF 표면처리와 수복치료을 당일에 모두 시행하지 않고 2회로 분리하여 치료하면 최종 수복물의 전단 결합 강도를 향상시킬 수 있다고 제시했다. 이러한 결과는 SDF가 충분히 작용할 수 있는 시간을 확보함으로써 해당 기간 동안 SDF의 은 이온이 상아세관으로 더 광범위하게 침투할 수 있다는 사실을 근거로한다[14,47,48]. 은 이온은 상아질 콜라겐 기질 단백질을 분해하여 결합 손실을 일으키는 MMPs와 시스테인 카텝신(cysteine cathepsins)효소를 억제하는 효과가 있다[9,49,50]. SDF/PI 표면처리와 RMGI수복의 간격이 1주일 간격이 있을 때 결합 강도가 증가한 결과는, SDF처리 후 즉일 RMGI를 수복하는 것이 아니라, 일주일 후 정도의 다음 내원에 시행하는 것이 임상 결과를 좋게 한다는 것을 시사한다.
본 연구의 결과를 임상에 적용하기 위해서는 SDF/PI의 구체적인 사용 방법과 주의사항을 이해하는 것이 중요하다. 임상에서 SDF/PI를 효과적으로 사용하기 위한 가이드라인은 다음과 같다:
1. SDF/PI 적용 시간[27]
o SDF: 치아에 충분히 흡수될 수 있도록 최소 1분간 적용한다. 이는 모세관 현상을 통해 SDF가 치아 구조 내로 침투하는 데 필요한 시간이다.
o PI: SDF 적용 직후 적용하며, 더 이상 흰색 침전물이 생기지 않을 때까지 1~3회 반복 적용한다. 이는 은 이온과 요오드 이온의 반응을 완료하여 착색을 최소화 하기 위함이다.
2. 적용 후 처치 방법[20,27,51]
o 다발성 우식이나 치근 우식과 같이 즉각적인 수복이 어려운 경우, SDF/PI 적용 2~4주 후 재평가를 실시한다. 이때 끝이 뭉툭한 탐침(ball-ended probe)을 사용하여 병변의 경도를 확인한다. 여전히 병변이 부드럽다면 SDF/PI를 재적용한다.
o 와동이 형성된(cavitated) 우식의 경우, SDF/PI 적용 후 적절한 수복 재료를 사용하여 수복하는 것이 권장된다. 본 연구 결과에 따르면, SDF/PI 적용 1주일 후 RMGI로 수복하는 것이 결합 강도 측면에서 유리할 수 있다.
3. 환자 및 보호자 주의사항[52]
o SDF에 포함된 은에 대한 알레르기 가능성을 사전에 확인해야 한다. 은 알레르기가 있는 환자의 경우 대체 치료법을 고려해야 한다.
o PI 용액은 태아에 유해할 수 있으므로 임신 및 수유 중인 여성에게는 금기 사항임을 명확히 설명한다. 이러한 환자군에게는 대체 치료법을 제시해야 한다.
o SDF 적용 시 주변 연조직 보호의 중요성을 설명한다. 러버댐이나 바세린 등으로 주변 조직을 적절히 보호하지 못했을 경우, 일시적인 궤양성 치은염이 발생할 수 있음을 환자와 보호자에게 미리 고지한다. 이러한 증상은 일반적으로 48시간 내에 자연 치유된다
4. 후속 관리
o SDF/PI 적용 후 정기적인 follow-up이 중요함을 강조한다. 초기에는 2~4주 간격으로, 이후에는 3~6개월 간격으로 재평가를 실시하여 우식의 진행 여부를 모니터링한다.
o 환자의 구강 위생 관리 능력과 식이 습관에 따라 재적용 주기를 조절할 수 있다. 고위험군 환자의 경우 더 짧은 간격으로 재적용을 고려할 수 있다.
이러한 임상 적용 가이드라인을 통해 치과 의사들은 본 연구 결과를 실제 진료 환경에 효과적으로 적용할 수 있을 것이다. SDF/PI의 적절한 사용은 특히 행동 조절이 어려운 소아 환자, 장애인 환자, 또는 고령 환자 등 전통적인 치과 치료가 어려운 환자군에서 우식 관리의 새로운 대안이 될 수 있다. 또한, 본 연구에서 확인된 SDF/PI의 항균 효과와 재광화 촉진 효과는 예방적 측면에서도 큰 가치가 있으므로, 고위험군 환자의 우식 예방 프로그램에도 적극적으로 활용될 수 있을 것이다.
V. 이해상충(Conflicts of Interest)
저자들은 이해상충이 없음을 선언한다.
Acknowledgements
The artificial saliva used in this study was prepared with the assistance of Professor Sung-Hoon Lee from the Department of Microbiology, Dankook University College of Dentistry.