| J Korean Dent Assoc > Volume 62(10); 2024 > Article |
|
Abstract
This study evaluated the effects of silver diamine fluoride (SDF) and potassium iodide (PI) on carious dentin. The antibacterial efficacy, surface hardness, and bond strength of resin-modified glass ionomer cement (RMGI) were assessed. Dentin specimens were prepared and subjected to artificial caries formation. The antibacterial effect of SDF/PI was compared to sodium fluoride varnish using Streptococcus mutans colony counts. Surface microhardness was measured using the Vickers hardness test. Shear bond strength of RMGI to treated surfaces was evaluated after thermocycling. Results showed that SDF/PI had superior antibacterial effects compared to NaF varnish. Surface hardness significantly increased one week after SDF/PI application. While SDF/PI treatment did not immediately affect RMGI bond strength to carious dentin, delayed bonding after one week significantly improved bond strength. These findings suggest that SDF/PI is effective in arresting caries and enhancing remineralization of carious dentin. The study also indicates that delaying restoration placement for one week after SDF/PI application may be beneficial for improving bond strength. This research provides valuable insights into the clinical application of SDF/PI for caries management and subsequent restorative procedures.
ņ╣śņĢä ņÜ░ņŗØņ”ØņØĆ ņĀä ņäĖĻ│äņĀüņ£╝ļĪ£ Ļ░Ćņן ĒØöĒĢ£ ļ¦īņä▒ ņ¦łĒÖś ņżæ ĒĢśļéśļĪ£ Ļ░£ņØĖņØś ņéČņØś ņ¦łĻ│╝ Ļ│Ąņżæ ļ│┤Ļ▒┤ņŚÉ ņāüļŗ╣ĒĢ£ ņśüĒ¢źņØä ļ»Ėņ╣śĻ│Ā ņ׳ļŗż[1]. ņØ┤ļ¤¼ĒĢ£ ļ¦źļØĮņŚÉņä£ Silver Diamine Fluoride(SDF)Ļ░Ć "caries silver-fluoride bullet"ņØ┤ļØ╝ ļČłļ”┤ ļ¦īĒü╝ ņ╣śņĢäņÜ░ņŗØņ”Ø Ļ┤Ćļ”¼ņŚÉ ņ׳ņ¢┤ ņāłļĪ£ņÜ┤ ņĀæĻĘ╝ļ▓Ģņ£╝ļĪ£ ņŻ╝ļ¬®ļ░øĻ│Ā ņ׳ļŗż[2,3].
SDFņØś ņ×äņāü ņĀüņÜ®ņØĆ 1960ļģäļīĆ ņØ╝ļ│ĖņŚÉņä£ ņŗ£ņ×æļÉśņŚłļŹś ļ░ö ņ׳ļŗż. ņØ╝ļ│Ė ņśżņé¼ņ╣┤ ļīĆĒĢÖņØś Nishino ļō▒(1969) [4]ļō▒ņØ┤ ņ╣śņĢäņÜ░ņŗØņ”ØņØś ņśłļ░®Ļ│╝ ņ╣śļŻīļź╝ ņ£äĒĢ┤ 38% SDF ņÜ®ņĢĪņØä Ļ░£ļ░£ĒĢśņśĆĻ│Ā, ņØ┤ļŖö ņØ╝ļ│ĖņŚÉņä£ ņĄ£ņ┤łņØś SDF ņĀ£ĒÆłņØĖ Saforide┬«(Bee Brand Medico Dental Co, Ltd)ņØś ņŖ╣ņØĖņ£╝ļĪ£ ņØ┤ņ¢┤ņĪīļŗż[5,6].
SDFļŖö ĒĢŁĻĘĀĒÜ©Ļ│╝ļź╝ ļŗ┤ļŗ╣ĒĢśļŖö 24~28%(w/v)ņØś ņØĆ ĒÖöĒĢ®ļ¼╝(ļåŹļÅä 253,870 ppm)Ļ│╝ ņ×¼Ļ┤æĒÖöĒÜ©Ļ│╝ļź╝ Ļ░¢ļŖö 5~6%(w/v)ņØś ļČłņåī ņØ┤ņś©(ļåŹļÅä 44,800 ppm), ĻĘĖļ”¼Ļ│Ā ļåŹļÅäņĢłņĀĢĒÖöļź╝ ņ£äĒĢ£ ņĢĮ 8%ņØś ņĢöļ¬©ļŗłņĢäļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ļŗż[2,7]. SDFņØś ņØĆņØ┤ Ļ░Ćņ¦ä ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļŖö ņŚ¼ļ¤¼ ļ®öņ╗żļŗłņ”śņØä ĒåĄĒĢ┤ ņØ┤ļŻ©ņ¢┤ņ¦äļŗż. ņäĖĻĘĀ ņé¼ļ®Ėņŗ£ĒéżĻ│Ā ļ░öņØ┤ņśżĒĢäļ”ä ĒśĢņä▒ņØä ņ¢ĄņĀ£ĒĢśļ®░, ņŻĮņØĆ ņäĖĻĘĀņØ┤ ņŻ╝ļ│Ć ĒÖśĻ▓ĮņŚÉ ņØĆņØä ņ×¼ļ░®ņČ£ĒĢśļŖö "ņóĆļ╣ä ĒÜ©Ļ│╝"ļĪ£ SDFļź╝ ņ×¼ĒÖ£ņä▒ĒÖöņŗ£ņ╝£ ņé┤ņĢäņ׳ļŖö ņäĖĻĘĀņØä Ēæ£ņĀüņ£╝ļĪ£ ņé╝ļŖöļŗż[8]. SDFņŚÉ ĒżĒĢ©ļÉ£ ļČłņåīļŖö ņ╣śņĢäņØś ņ╣╝ņŖś ļ░Å ņØĖņé░ņŚ╝Ļ│╝ ļ░śņØæĒĢśņŚ¼ ļČłĒÖöņłśņé░ĒÖöņØĖĒÜīņäØņØä ĒśĢņä▒ĒĢ£ļŗż. ļśÉĒĢ£ SDFņØś ņĢīņ╣╝ļ”¼ņä▒ņØĆ ņé░ņä▒ņØä ņżæĒÖöņŗ£ņ╝£ ĻĖ░ņ¦łĻĖłņåŹļŗ©ļ░▒ļČäĒĢ┤ĒÜ©ņåī(MMPs, Matrix Metalloproteinases) Ļ░ÖņØĆ ņ£ĀĻĖ░ ĻĖ░ņ¦łņØä ĒīīĻ┤┤ĒĢśļŖö ĒÜ©ņåīļź╝ ļ╣äĒÖ£ņä▒ĒÖöĒĢśĻ│Ā ņ×¼Ļ┤æĒÖöļź╝ ņ┤ēņ¦äĒĢ£ļŗż[9].
ļ╣äļĪØ SDFĻ░Ć ĒāĆņĢĪ ņāØļ¼╝ļ¦ēĻ│╝ ņ╣śņĢä ļ▓Ģļ×æņ¦łņŚÉ ļīĆĒĢ┤ ņ£ĀĒÜ©ĒĢ£ ĒĢŁļ»ĖņāØļ¼╝ ĒÜ©Ļ│╝ļź╝ ļ│┤ņØĖļŗżļŖö Ļ▓āņØ┤ ļ░ØĒśĆņĪīņ£╝ļéś[10], SDFņØś Ļ░Ćņן ĒØöĒ׳ ļ│┤Ļ│ĀļÉśļŖö ļČĆņ×æņÜ®ņØĆ ļ│Ćņāēņ£╝ļĪ£ ņ╣śņĢäļź╝ Ļ▓ĆņØĆņāē ļśÉļŖö ņ¦ÖņØĆ Ļ░łņāēņ£╝ļĪ£ ļ│ĆĒÖöņŗ£Ēé©ļŗż. ņØ┤ļ¤¼ĒĢ£ ļ│Ćņāē ļ¼ĖņĀ£ļŖö SDF ņĀüņÜ® ņ¦üĒøä ņÜöļō£ĒÖö ņ╣╝ļź©(PI, Potassium Iodide)ņØä ļÅäĒżĒĢ©ņ£╝ļĪ£ņŹ© ĒĢ┤Ļ▓░ĒĢĀ ņłś ņ׳ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż. PI ņŚ╝ņØĆ ļé©ņĢäņ׳ļŖö ņØĆ ņØ┤ņś©Ļ│╝ ļ░śņØæĒĢśņŚ¼ ņØĖņé░ņØĆņØś ĒśĢņä▒ņØä ļ░®ņ¦ĆĒĢśĻ│Ā ļ│ĆņāēņØä ņśłļ░®ĒĢ£ļŗż[11]. ĒĢśņ¦Ćļ¦ī ņØ╝ļČĆ ņŚ░ĻĄ¼ņŚÉņä£ļŖö PIĻ░Ć ņØĆ ņØ┤ņś©ņØś ņłśļź╝ ņżäņ×äņ£╝ļĪ£ņŹ© SDFņØś ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ Ļ░Éņåīņŗ£Ēé©ļŗżļŖö Ļ▓░Ļ│╝ļÅä ņ׳ļŗż[12].
SDFņØś ņ×äņāüņĀü ĒÜ©ļŖźņØĆ ļŗżņ¢æĒĢśņ¦Ćļ¦ī, ĻĘĖ ĒÜ©Ļ│╝ņÖĆ Ļ┤ĆļĀ©ļÉ£ ļ¬ć Ļ░Ćņ¦Ć ņżæņÜöĒĢ£ ņ¦łļ¼ĖļōżņØ┤ ņŚ¼ņĀäĒ׳ ļé©ņĢäņ׳ļŗż. ņ▓½ņ¦Ė, SDFņÖĆ PIņØś ņĪ░ĒĢ®ņØ┤ ĻĖ░ņĪ┤ņØś ļČłņåī ļ░öļŗłņē¼ņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ ņ¢┤ļ¢ż ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļé┤ļŖöņ¦ĆņŚÉ ļīĆĒĢ£ ņ¦üņĀæņĀüņØĖ ļ╣äĻĄÉ ņŚ░ĻĄ¼Ļ░Ć ļČĆņĪ▒ĒĢśļŗż. ļæśņ¦Ė, SDF/PI ņ▓śļ”¼Ļ░Ć ņØĖĻ│Ą ņÜ░ņŗØ ņāüņĢäņ¦łņØś Ēæ£ļ®┤ Ļ▓ĮļÅäņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņĀ£ĒĢ£ņĀüņØ┤ļŗż. ļ¦łņ¦Ćļ¦ēņ£╝ļĪ£, SDF/PI ņ▓śļ”¼ Ēøä ņłśļ│Ą ņ×¼ļŻīņØś Ļ▓░ĒĢ® Ļ░ĢļÅäņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝Ļ░Ć ņØ╝Ļ┤ĆļÉśņ¦Ć ņĢŖļŗż[13,14].
ļö░ļØ╝ņä£ ļ│Ė ņŚ░ĻĄ¼ņØś ļ¬®ņĀüņØĆ ļŗżņØīĻ│╝ Ļ░Öļŗż:
1. 38% SDFņÖĆ PIņØś ņØĖĻ│Ą ņāüņĢäņ¦ł ņÜ░ņŗØņŚÉ ļīĆĒĢ£ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ 5% ļČłĒÖöļéśĒŖĖļź©(NaF, Sodium Fluoride) ļ░öļŗłņē¼ņÖĆ ļ╣äĻĄÉ ĒÅēĻ░ĆĒĢ£ļŗż.
2. SDF/PIĻ░Ć ņØĖĻ│Ą ņāüņĢäņ¦ł ņÜ░ņŗØņØś Ēæ£ļ®┤ Ļ▓ĮļÅäņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ĒÅēĻ░ĆĒĢ£ļŗż.
3. SDF ņ▓śļ”¼ļÉ£ ĒāłĒÜī ņāüņĢäņ¦łņŚÉ ļīĆĒĢ£ ļĀłņ¦äĻ░ĢĒÖöĒśĢ ĻĖĆļלņŖżņĢäņØ┤ņśżļģĖļ©Ė(RMGI, Resin modified glass ionomer) ņØś ņĀäļŗ© Ļ▓░ĒĢ® Ļ░ĢļÅä(SBS, Shear Bond Strength)ņŚÉ ņ׳ņ¢┤ ņ”ēņŗ£ ļ░Å ņ¦ĆņŚ░ ļČĆĒĢś ņŗ£Ļ░äņØś ĒÜ©Ļ│╝ļź╝ ĒÅēĻ░ĆĒĢ£ļŗż.
ņØ┤ļź╝ ņ£äĒĢ┤ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö Streptococcus mutansļź╝ ņØ┤ņÜ®ĒĢ£ ņØĖĻ│Ą ņÜ░ņŗØ ļ¬©ļŹĖ, Vickers ļ»ĖņäĖĻ▓ĮļÅä ņĖĪņĀĢ, ĻĘĖļ”¼Ļ│Ā ņĀäļŗ© Ļ▓░ĒĢ® Ļ░ĢļÅä ĒģīņŖżĒŖĖļź╝ ņŗżņŗ£ĒĢśņśĆņ£╝ļ®░, ņØ┤ļ¤¼ĒĢ£ ņĀæĻĘ╝ņØä ĒåĄĒĢ┤ SDF/PIņØś ĒÜ©Ļ│╝ņÖĆ ņ×äņāüņĀü ņĀüņÜ®ņŚÉ ļīĆĒĢ£ ņØ┤ĒĢ┤ļź╝ ņ¢╗Ļ│Āņ×É Ē¢łļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö ĒŚ¼ņŗ▒Ēéż ņäĀņ¢ĖņØś ņ¦Ćņ╣©ņŚÉ ļö░ļØ╝ ņłśĒ¢ēļÉśņŚłņ£╝ļ®░, ļŗ©ĻĄŁļīĆĒĢÖĻĄÉ ņ╣śĻ│╝ļ│æņøÉ ĻĖ░Ļ┤ĆņāØļ¬ģņ£żļ”¼ņ£äņøÉĒÜī(IRB)ņØś ņŖ╣ņØĖņØä ļ░øņĢśļŗż(ņŖ╣ņØĖļ▓łĒśĖ: DKUDH IRB 2023-06-004).
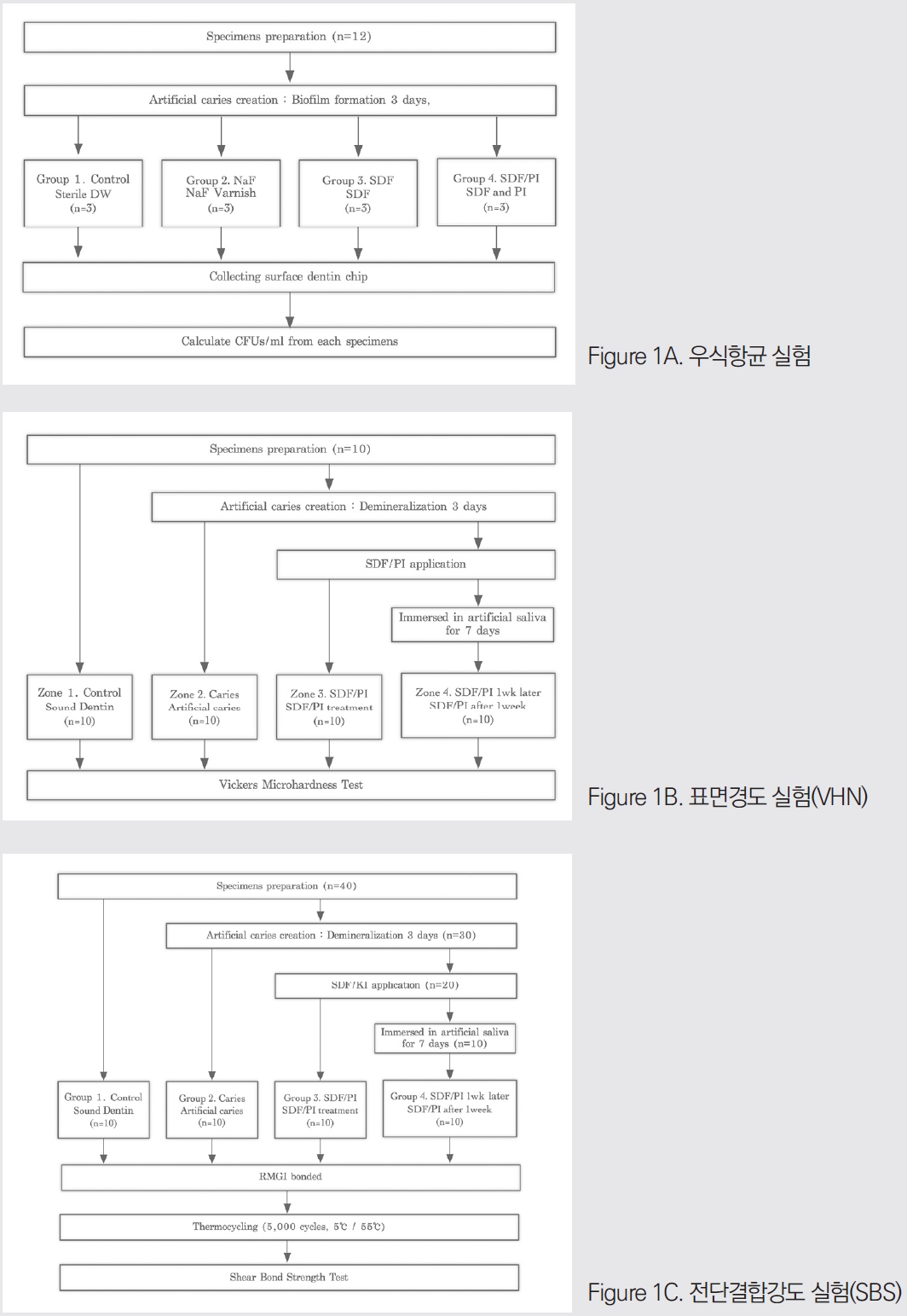
Ļ▒┤ņĀäĒĢ£ ņśüĻĄ¼ļīĆĻĄ¼ņ╣śļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ 12Ļ░£ņØś ņāüņĢäņ¦ł ļĖöļĪØ(5 x 5 x 5mm┬│)ņØä ņżĆļ╣äĒĢśņśĆļŗż. ņāüņĢäņ¦ł ņŗ£ĒÄĖņØĆ ņĢäĒü¼ļ”┤ļ”ŁļĀłņ¦ä(Ortho-jet, Lang Dental Mfg., Wheeling, IL, USA)ņŚÉ ļ¦żļ”ĮĒĢśņŚ¼ ņāüņĢäņ¦ł ņŗ£ĒÄĖņØś ņśżņ¦ü ĒĢ£ ļŗ©ļ®┤ļ¦īņØ┤ ļģĖņČ£ļÉśļÅäļĪØ ĒĢśņśĆļŗż. Ēæ£ļ®┤ņØĆ 200, 400, 600gitņØś ņŗżļ”¼ņĮś ņ╣┤ļ░öņØ┤ļō£ ņé¼ĒżļĪ£ ņŚ░ļ¦łĒĢśņŚ¼ Ēæ£ņżĆĒÖöļÉ£ ļÅäļ¦ÉņĖĄņØä ņāØņä▒ĒĢśņśĆļŗż. ļ¬©ļōĀ ņŗ£ĒÄĖņØĆ ļ®ĖĻĘĀ Ēøä, ņØĖĻ│Ą ņāüņĢäņ¦ł ņÜ░ņŗØņØä ļ¦īļōżĻĖ░ ņ£äĒĢ┤ Streptococcus mutans(ATCC 25175) ĻĘĀņŻ╝ļź╝ 37ŌäāņŚÉņä£ 1.5%(w/v) ĒĢ£ņ▓£ņØä ĒżĒĢ©ĒĢ£ BHI(Brain Heart Infusion) ļ░░ņ¦ĆņŚÉņä£ ļ░░ņ¢æĒĢśņśĆļŗż. ļ░öņØ┤ņśżĒĢäļ”ä ĒśĢņä▒ņØä ņ£äĒĢ┤, ĒĢśļŻ╗ļ░ż ļ░░ņ¢æĒĢ£ ĻĘĀņŻ╝ļź╝ 5% ņ×Éļŗ╣ņØä ĒżĒĢ©ĒĢ£ BHIļ░░ņ¦ĆņŚÉ 1:100ņ£╝ļĪ£ ĒؼņäØĒĢśņśĆļŗż. ņāüņĢäņ¦ł ļĖöļĪØņØ┤ ļōżņ¢┤ņ׳ļŖö 6-well ĒöīļĀłņØ┤ĒŖĖņØś Ļ░ü wellņŚÉ 1 mLņØś ļ░ĢĒģīļ”¼ņĢä ļ░░ņ¢æņĢĪņØä ņĀæņóģĒĢ£ Ēøä, 37ŌäāņŚÉņä£ 72ņŗ£Ļ░ä ļÅÖņĢł ļ░░ņ¢æĒĢśņśĆļŗż. ņāüņĢäņ¦ł ļĖöļĪØņŚÉ Ļ▓░ĒĢ®ĒĢśņ¦Ć ņĢŖņØĆ ņäĖĒżļź╝ ņäĖņ▓ÖĒĢ£ Ēøä, ņāüņĢäņ¦ł ļĖöļĪØņØä ņāüņĢäņ¦ł Ēæ£ļ®┤ ņ▓śļ”¼ ļ░®ļ▓ĢņŚÉ ļö░ļØ╝ ļ¼┤ņ×æņ£äļĪ£ 4Ļ░£ ĻĘĖļŻ╣ņ£╝ļĪ£ ļéśļłäņŚłļŗż(Fig. 1A).
ĻĘĖļŻ╣ 1 : Sterilized deionized water(ļīĆņĪ░ĻĄ░)
ĻĘĖļŻ╣ 2 : 5% Sodium Fluoride Varmish(Clinpro, 3M ESPE, St Paul, MN, USA)
ĻĘĖļŻ╣ 3 : 38% Sodium Diamine Fluoride(Riva star, SDI, Bayswater, Australia)
ĻĘĖļŻ╣ 4 : Potassium Iodide after 38% SDF(Riva star, SDI, Bayswater, Australia)
ļ¬©ļōĀ ļĖöļĪØņØĆ ĻĄ¼Ļ░Ģ ĒÖśĻ▓ĮņØä ļ¬©ļ░®ĒĢśĻĖ░ ņ£äĒĢ┤ Macknight-HaneņÖĆ WhitfordĻ░Ć 1992ļģäņŚÉ ļ░£Ēæ£ĒĢ£ ļ░®ļ▓ĢņŚÉ ļö░ļØ╝ ņĀ£ņĪ░ĒĢ£ ņØĖĻ│ĄĒāĆņĢĪņŚÉ 37Ōäā, 1ņŗ£Ļ░ä ļÅÖņĢł ņ╣©ņĀäņŗ£ņ╝░ļŗż. ņØ┤Ēøä ņĀĆņåŹ ņ╗©ĒŖĖļØ╝ņĢĄĻĖĆ ĒĢĖļō£Ēö╝ņŖżņŚÉ ņןņ░®ļÉ£ ļ®ĖĻĘĀ ļØ╝ņÜ┤ļō£ ļ▓äļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņāüņĢäņ¦ł ņ╣®ņØä ņłśņ¦æĒĢśņśĆļŗż. ņāüņĢäņ¦ł ņ╣®ņØĆ BHI ļ░░ņ¦Ć(1mL)ņŚÉ ĻĘĀņ¦łĒÖö ĒĢśņśĆņ£╝ļ®░, ņØ┤ļĀćĻ▓ī ĒśĢņä▒ļÉ£ ņäĖĻĘĀ Ēś╝ĒāüņĢĪņØä BHI ļ░░ņ¢æņĢĪņØä ņØ┤ņÜ®ĒĢśņŚ¼ 10~104ļ░░ļĪ£ ņŚ░ņåŹĒؼņäØĒĢśņśĆļŗż. Ļ░üĻ░ü ĒؼņäØļÉ£ ņäĖĻĘĀ Ēś╝ĒāüņĢĪņØä BHI ĒĢ£ņ▓£ ĒöīļĀłņØ┤ĒŖĖņŚÉ ļÅäļ¦É Ēøä 37ŌäāņŚÉņä£ 2ņØ╝Ļ░ä ļ░░ņ¢æ Ēøä ņ¦æļØĮĒśĢņä▒ļŗ©ņ£ä(CFU, colony forming unit)ļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. ņ£äņÖĆ Ļ░ÖņØĆ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ ĒģīņŖżĒŖĖļź╝ ĒåĄĒĢ┤ ņ┤Ø 3ĒÜīņØś ļÅģļ”ĮņĀüņØĖ ņŗżĒŚśņ£╝ļĪ£ ļ░śļ│ĄĒĢśņśĆļŗż.
Ēæ£ļ®┤ Ļ▓ĮļÅä ĒÅēĻ░Ćļź╝ ņ£äĒĢ┤ 10Ļ░£ņØś Ļ▒┤ņĀäĒĢ£ ņśüĻĄ¼ļīĆĻĄ¼ņ╣ś ņ╣śņĢä ņŗ£ĒÄĖņØä ņé¼ņÜ®ĒĢśņśĆļŗż. ĻĄÉĒĢ®ļ®┤ņØś ļ▓Ģļ×æņ¦łņØä ĒØÉļź┤ļŖö ļ¼╝ ņĢäļלņŚÉņä£ ļ¬©ļŹĖ ĒŖĖļ”¼ļ©ĖļĪ£ ņĀ£Ļ▒░ĒĢ£ Ēøä ņ╣śņĢäļź╝ ņøÉĒśĢ ĒöīļØ╝ņŖżĒŗ▒ ļ¬░ļō£ļź╝ ĒåĄĒŚż ņĢäĒü¼ļ”┤ļ”ŁļĀłņ¦ä(Ortho-jet, Lang Dental Mfg., Wheeling, IL, USA)ņ£╝ļĪ£ ļ¦żļ”ĮĒĢśņśĆļŗż. Ēæ£ļ®┤ņØĆ 200, 400, 600 ĻĘĖļ”┐ņØś ņŗżļ”¼ņĮś ņ╣┤ļ░öņØ┤ļō£ ņé¼ĒżļĪ£ ņŚ░ļ¦łĒĢśņŚ¼ Ēæ£ņżĆĒÖöļÉ£ ļÅäļ¦ÉņĖĄņØä ņāØņä▒ĒĢśņśĆļŗż. Ļ░ü ņŗ£ĒÄĖņØĆ ļŗ©ņØ╝ ņŗ£ĒÄĖ ļé┤ņŚÉņä£ 4ļŗ©Ļ│ä ņł£ņä£ļĪ£ ņ¦äĒ¢ēĒĢśļŖö Ēæ£ļ®┤ ņ▓śļ”¼ ĻĄ¼ņŚŁņ£╝ļĪ£ ļČäĒĢĀĒĢśņśĆļŗż(Fig. 1B).
ĻĄ¼ņŚŁ 1 : Ļ▒┤ņĀä ņāüņĢäņ¦ł Ēæ£ļ®┤ ļÅäļ¦ÉņĖĄ ĒśĢņä▒ Ēøä, Ēæ£ļ®┤Ļ▓ĮļÅä ņĖĪņĀĢ.
ĻĄ¼ņŚŁ 2 : ņØĖĻ│ĄņÜ░ņŗØņØä ĒåĄĒĢ£ ĒāłĒÜī Ēøä, Ēæ£ļ®┤Ļ▓ĮļÅä ņĖĪņĀĢ.
ĻĄ¼ņŚŁ 3 : SDFļ░Å PI ņĀüņÜ® Ēøä, Ēæ£ļ®┤Ļ▓ĮļÅä ņĖĪņĀĢ.
ĻĄ¼ņŚŁ 4 : SDFņÖĆ PI ņĀüņÜ® 1ņŻ╝ņØ╝ Ēøä, Ēæ£ļ®┤Ļ▓ĮļÅä ņĖĪņĀĢ.
ļ╣äņ╗żņŖż Ļ▓ĮļÅä(VHN, Vickers Hardness Number)ļŖö ļ╣äņ╗żņŖż ļ»ĖņäĖĻ▓ĮļÅä ņŗ£ĒŚśĻĖ░(HM-211, Mitutoyo, Kanagawa, Japan)ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ Ēö╝ļØ╝ļ»Ėļō£ĒśĢ ļŗżņØ┤ņĢäļ¬¼ļō£ ņĢĢņ×ģĻĖ░ļź╝ ĒåĄĒĢ┤ ņŗżņś©ņŚÉņä£ 10ņ┤ł ļÅÖņĢł 200gņØś ĒĢśņżæņØä Ļ░ĆĒĢ┤ ņĖĪņĀĢĒĢśņśĆļŗż. VHNņØĆ Ļ░ü ņāüņĢäņ¦ł Ēæ£ļ®┤ ĻĄ¼ņŚŁ ļé┤ņŚÉņä£ 3ĒÜī ņĖĪņĀĢĒĢśņŚ¼ Ļ░ü ņāśĒöīņØś ĒÅēĻĘĀ ļ»ĖņäĖĻ▓ĮļÅä Ļ░ÆņØä Ļ│äņé░ĒĢśņśĆļŗż.
ņĀäļŗ© Ļ▓░ĒĢ® Ļ░ĢļÅä ĒÅēĻ░Ćļź╝ ņ£äĒĢ┤ 40Ļ░£ņØś ņŗ£ĒÄĖņØä ņé¼ņÜ®ĒĢśņśĆļŗż. ņŗ£ĒÄĖņØĆ VHN ĒģīņŖżĒŖĖņÖĆ ļÅÖņØ╝ĒĢ£ ļ░®ļ▓Ģņ£╝ļĪ£ ņżĆļ╣äĒĢśĻ│Ā ļ¼┤ņ×æņ£äļĪ£ 4Ļ░£ņØś ĒĢśņ£ä ĻĘĖļŻ╣ņ£╝ļĪ£ ļ░░ņĀĢĒĢśņśĆļŗż(Fig. 1C)
ĻĘĖļŻ╣ 1 : Ļ▒┤ņĀä ņāüņĢäņ¦ł Ēæ£ļ®┤, ļīĆņĪ░ĻĄ░(n=10)
ĻĘĖļŻ╣ 2 : ņØĖĻ│ĄņÜ░ņŗØņØ┤ ņ×¼ĒśäļÉ£ ņāüņĢäņ¦ł Ēæ£ļ®┤(n=10)
ĻĘĖļŻ╣ 3 : ņØĖĻ│ĄņÜ░ņŗØņØ┤ ņ×¼ĒśäļÉ£ Ēæ£ļ®┤ņŚÉ, SDFļ░Å PI ņ▓śļ”¼(n=10)
ĻĘĖļŻ╣ 4 : ņØĖĻ│ĄņÜ░ņŗØņØ┤ ņ×¼ĒśäļÉ£ Ēæ£ļ®┤ņŚÉ, SDFļ░Å PI ņ▓śļ”¼ 1 ņŻ╝ņØ╝ Ēøä(n=10)
Ļ░ü ņŗ£ĒÄĖņØä ļ│Ėļö® Ēü┤ļשĒöä(UltraTester, Ultradent Products, Inc., Utah, USA)ņŚÉ Ļ│ĀņĀĢĒĢ£ Ēøä, RMGIļź╝ ļ│Ėļö® ļ¬░ļō£ ņØĖņä£ĒŖĖ(UltraTester, Ultradent Products, INC., Utah, USA)ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņ▒äņøĀļŗż. RMGIļź╝ ņČ®ņĀäĒĢśĻĖ░ ņĀä, ņāüņĢäņ¦ł ņ╗©ļööņģöļäłļĪ£ Ēæ£ļ®┤ ņĀäņ▓śļ”¼ļź╝ ņłśĒ¢ēĒĢśņśĆļŗż.
ņżæĒĢ® Ēøä, ņŗ£ĒÄĖņØä ļ¬░ļō£ņŚÉņä£ ņĪ░ņŗ¼ņŖżļ¤ĮĻ▓ī ņĀ£Ļ▒░ĒĢśĻ│Ā ņŚ┤ņł£ĒÖśĻĖ░ņŚÉņä£ 5Ōäā ļ░Å 55Ōäā Ļ░ä ņŚ┤ņł£ĒÖś ņ▓śļ”¼ļź╝ 5000ĒÜī ņłśĒ¢ēĒĢśņśĆļŗż. ĻĘĖ Ēøä ņŗ£ĒÄĖņØä ņĀäļŗ© Ļ▓░ĒĢ® Ļ░ĢļÅä ņŗ£ĒŚśĻĖ░(Shear Bond Tester, Bisco, Illinois, USA)ņŚÉ ņןņ░®ĒĢśĻ│Ā, ņĀæņ░® ņŗżĒī©Ļ░Ć ļ░£ņāØĒĢĀ ļĢīĻ╣īņ¦Ć 0.5 mm/ļČäņØś ņåŹļÅäļĪ£ ņĀäļŗ©ļĀźņØä Ļ░ĆĒĢ┤ ņĀäļŗ©Ļ▓░ĒĢ®Ļ░ĢļÅäļź╝ ņĖĪņĀĢĒĢśņśĆļŗż.
ĒĢŁĻĘĀ ņŗżĒŚśņØś ļ¬©ļōĀ ļŹ░ņØ┤Ēä░ļŖö SAS ĒöäļĪ£ĻĘĖļש(SAS software, SAS Institute Inc., Cary, NC, USA)ņØä ņé¼ņÜ®ĒĢśņŚ¼ Student's ttestļĪ£ ļČäņäØĒĢśņśĆļŗż. ļ╣äņ╗żņŖż ļ»ĖņäĖĻ▓ĮļÅä ļ░Å ņĀäļŗ© Ļ▓░ĒĢ® Ļ░ĢļÅä ĒģīņŖżĒŖĖ ļŹ░ņØ┤Ēä░ļŖö IBM SPSS statistics 21.0(IBM corp, New York, USA)ņØä ņé¼ņÜ®ĒĢśņŚ¼ ĒåĄĻ│äņĀüņ£╝ļĪ£ ļČäņäØĒĢśņśĆļŗż. ļ╣äņ╗żņŖż ļ»ĖņäĖĻ▓ĮļÅä ĒģīņŖżĒŖĖņÖĆ ņĀäļŗ© Ļ▓░ĒĢ® Ļ░ĢļÅä ĒģīņŖżĒŖĖļŖö ņØ╝ņøÉļ░░ņ╣ś ļČäņé░ļČäņäØĻ│╝ ņé¼Ēøä Tukey Ļ▓ĆņĀĢņØä ņé¼ņÜ®ĒĢśņśĆļŗż. ņ£ĀņØśņłśņżĆņØĆ 5%ļĪ£ ĒĢśņśĆļŗż .
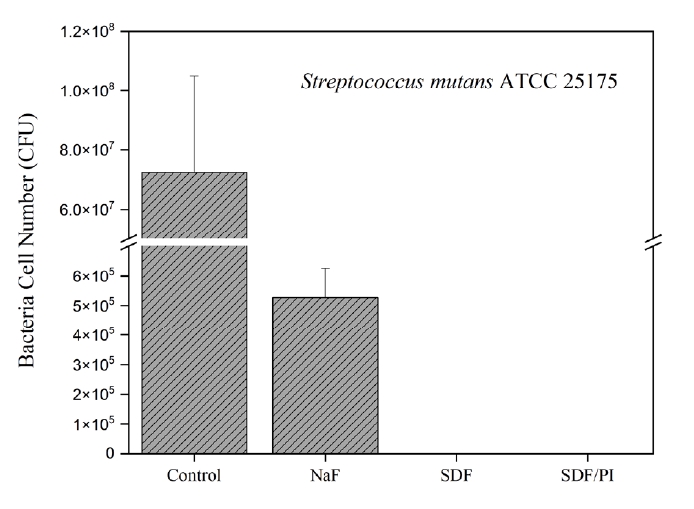
Fig. 2ļŖö Streptococcus mutansņØś CFU ĒÅēĻĘĀĻ░ÆĻ│╝ Ēæ£ņżĆĒÄĖņ░©ļź╝ ļ│┤ņŚ¼ņżĆļŗż. SDF+PI, SDF, NaF ĻĘĖļŻ╣ņŚÉņä£ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢ£ Ļ░ÉņåīĻ░Ć Ļ┤Ćņ░░ļÉśņŚłļŗż(p<0.05). SDF ĻĘĖļŻ╣ņØĆ PI ņÜ®ņĢĪ ņé¼ņÜ® ņŚ¼ļČĆļź╝ ļ¢Āļéś, NaF ĻĘĖļŻ╣ļ│┤ļŗż ņÜ░ņłśĒĢ£ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļāłļŗż(p<0.05).
ĒāłĒÜī ĒøäņÖĆ SDF/PI ņĀüņÜ® ņ¦üĒøäņØś VHNņŚÉļŖö ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż(Fig. 3). ĻĘĖļ¤¼ļéś SDF/PI ņĀüņÜ® 1ņŻ╝ņØ╝ ĒøäņŚÉļŖö VHNņØ┤ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņśĆļŗż(p<0.05).
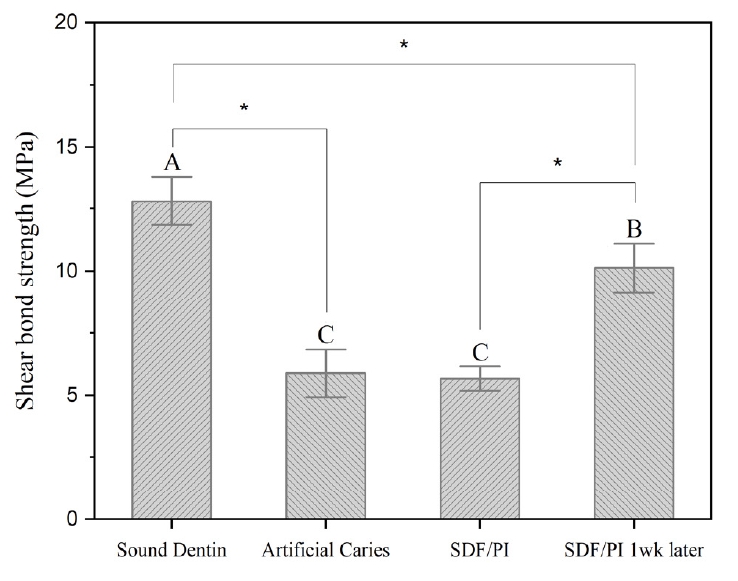
ņØĖĻ│Ą ņÜ░ņŗØ ņāüņĢäņ¦ł Ēæ£ļ®┤ņØś ņłśļ│Ą ņ×¼ļŻīņŚÉ ļīĆĒĢ£ Ļ▓░ĒĢ® Ļ░ĢļÅäļŖö Ļ▒┤ņĀä ņāüņĢäņ¦łņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī ļé«ņĢśļŗż(Fig. 4). ņØĖĻ│Ą ņÜ░ņŗØņŚÉ SDF/PIļź╝ ņĀüņÜ®ĒĢ£ Ēøä, RMGIļŖö ņ£Āņé¼ĒĢ£ Ļ▓░ĒĢ® Ļ░ĢļÅäļź╝ ļ│┤ņśĆļŗż. SDF/PI ņ▓śļ”¼ Ēøä, ņ”ēņŗ£ ņłśļ│ĄņŚÉ ļ╣äĒĢ┤ 1ņŻ╝ņØ╝ Ēøä ņ¦ĆņŚ░ ņĀæņ░®ĒĢ£ ĻĄ░ņØ┤ ļŹöņÜ▒ ļåÆņØĆ Ļ▓░ĒĢ® Ļ░ĢļÅäĻ░Ć Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņŚłļŗż(p<0.05).
SDFļŖö ņżæĻĄŁ, ņØ╝ļ│Ė, ļÅģņØ╝, ļäżĒīö, ļĖīļØ╝ņ¦ł, ņĢäļź┤ĒŚ©Ēŗ░ļéś, ļē┤ņ¦łļ×£ļō£, ĒśĖņŻ╝ ļō▒ ņŚ¼ļ¤¼ ĻĄŁĻ░ĆņŚÉņä£ ĒÖ£ņÜ®ļÉśĻ│Ā ņ׳ļŗż[15]. ĒśĖņŻ╝ņŚÉņä£ļŖö 1984ļģäļČĆĒä░ SDFĻ░Ć ņ╣śĻ│╝ ņ×äņāüņŚÉ ļÅäņ×ģļÉśņŚłņ£╝ļ®░[16], ļĖīļØ╝ņ¦łļÅä 1980ļģäļīĆ Ēøäļ░śļČĆĒä░ SDFņØś ņé¼ņÜ®ņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż[17]. ņżæĻĄŁņŚÉņä£ļŖö 2002ļģäļČĆĒä░ SDFļź╝ ņØ┤ņÜ®ĒĢ£ ņ╣śņĢä ņÜ░ņŗØ ņśłļ░® ĒöäļĪ£ĻĘĖļשņØ┤ ņŗ£ņ×æļÉśņŚłņ£╝ļ®░, ņØ┤Ēøä ņłśļ¦ÄņØĆ ņ×äņāü ņŗ£ĒŚśņØä ĒåĄĒĢ┤ SDFņØś ņÜ░ņŗØ ņĀĢņ¦Ć ĒÜ©Ļ│╝ļź╝ ĒÖĢņØĖĒĢ£ ļ░ö ņ׳ļŗż[18]. 2014ļģä ļ»ĖĻĄŁ ņŗØĒÆłņØśņĢĮĻĄŁ(Food and Drug Administration, FDA)ņØĆ SDFļź╝ ņ¦ĆĻ░üĻ│╝ļ»╝ņ”Ø ņ╣śļŻīļź╝ ņ£äĒĢ£ ņØśļŻīĻĖ░ĻĖ░ļĪ£ ņŖ╣ņØĖĒĢśņśĆņ£╝ļéś[19], ņ╣śņĢäņÜ░ņŗØņ”Ø ņ╣śļŻīņŚÉ ļīĆĒĢ£ ņé¼ņÜ®ņØĆ FDA ņŖ╣ņØĖņØä ļ░øņ¦Ć ņĢŖņØĆ ĒŚłĻ░ĆņÖĖņé¼ņÜ®(off-label use) ņāüĒā£ņśĆļŗż. 2016ļģä ļ»ĖĻĄŁņŚÉņä£ CDT(Current Dental Terminology) code D1354Ļ░Ć ņŖ╣ņØĖļÉśļ®┤ņä£ ņ╣śĻ│╝ņØśņé¼ļōżņØ┤ SDFļź╝ ņ╣śņĢä ņÜ░ņŗØņ”Ø ņ╣śļŻīņŚÉ ņé¼ņÜ®ĒĢ£ ņé¼ņŗżņØä ļ¼Ėņä£ĒÖöĒĢśĻ│Ā, ņØ┤ļź╝ ļ│┤ĒŚś ņ▓ŁĻĄ¼ņŚÉ ĒżĒĢ©ĒĢĀ ņłś ņ׳Ļ▓ī ļÉśņŚłļŗż. ņØ┤ ņĮöļō£ņØś ņŖ╣ņØĖņ£╝ļĪ£ SDFļź╝ ņé¼ņÜ®ĒĢ£ ņ╣śļŻīļź╝ ļ│┤ļŗż ņ▓┤Ļ│äņĀüņ£╝ļĪ£ ĻĖ░ļĪØĒĢśĻ│Ā, ĒÖśņ×ÉņØś ņÜ░ņŗØņ”Ø ņ¦äĒ¢ēņØä ņ¢ĄņĀ£ĒĢśļŖö ņ╣śļŻīļź╝ ļ¬ģĒÖĢĒĢśĻ▓ī ņ▓ŁĻĄ¼ĒĢĀ ņłś ņ׳ļŖö ĻĖ░ļ░śņØ┤ ļ¦łļĀ©ļÉ©ņŚÉ ļö░ļØ╝, 2018ļģä ļ»ĖĻĄŁņ╣śĻ│╝ņØśņé¼ĒśæĒÜī(American Dental Association, ADA)ļŖö ņÜ░ņŗØ ļ│æņåīņØś ņĀĢņ¦Ćļź╝ ņ£äĒĢ£ ņĀüņĀłĒĢ£ ņ╣śļŻī ņśĄņģśņ£╝ļĪ£ SDFņØś ņ▓┤Ļ│äņĀüņØĖ ņé¼ņÜ®ņØä ĻČīņןĒĢśĻĖ░ņŚÉ ņØ┤ļź┤ļĀĆļŗż[20]. 2020ļģäņŚÉļŖö ļīĆĒĢ£ļ»╝ĻĄŁņŚÉņä£ļÅä ņé¼ņÜ®ņØ┤ ņŖ╣ņØĖļÉśņ¢┤ ņÜ░ņŗØ ņĪ░ņĀłņŚÉ SDF ņé¼ņÜ®ņŚÉ ļīĆĒĢ£ ĻĖ░ļīĆĻ░Ć ļåÆņĢäņ¦ĆĻ│Ā ņ׳ļŗż[21].
SDFņØś ņ×äņāüņĀü ņĀüņØæņ”ØņØĆ ļŗżņ¢æĒĢśņ¦Ćļ¦ī ĒŖ╣Ē׳, ņÖĆļÅÖņØ┤ ĒśĢņä▒ļÉ£ ņÜ░ņŗØ ņ╣śņĢäņÖĆ ņ╣śĻĘ╝ Ēæ£ļ®┤ ņÜ░ņŗØņØś ņĀĢņ¦Ćļź╝ ņ£äĒĢ┤ 38% SDF ņÜ®ņĢĪņØ┤ ņČöņ▓£ļÉśĻ│Ā ņ׳ļŗż[22]. ĻĄ¼Ļ░ĢĻ▒┤ņĪ░ņ”ØņØ┤ļéś ņ£ĀņĢäĻĖ░ ņżæņ”Ø ņÜ░ņŗØņ”Ø ļō▒ ĻĘ╣ņŗ¼ĒĢ£ ņÜ░ņŗØņØś ņ£äĒŚśņØ┤ ņ׳ļŖö ĒÖśņ×É, Ē¢ēļÅÖņĪ░ņĀłņØ┤ ņ¢┤ļĀżņÜ┤ ņåīņĢä ļ░Å ņןņĢĀĻ░Ć ņ׳ņ¢┤ ĒĢ£ļ▓łņØś ļ░®ļ¼Ėņ£╝ļĪ£ ļ¬©ļōĀ ņ╣śļŻīĻ░Ć ņ¢┤ļĀżņÜ┤ ĒÖśņ×É, ĻĘĖļ”¼Ļ│Ā ļ░£ņ╣ś ņ¦üņĀäņØś ņ╣śĻĘ╝ ņÜ░ņŗØņ▓śļ¤╝ ņ╣śļŻīĻ░Ć Ļ│Āļ»╝ņŖżļ¤¼ņÜ┤ ņ£äņ╣śņØś ņÜ░ņŗØ ļ│æļ│ĆņØä Ļ░¢ļŖö ņ¢┤ļź┤ņŗĀ ĒÖśņ×É, ņ╣śĻ│╝ ņ╣śļŻīņŚÉ ņĀæĻĘ╝ņØ┤ ņ¢┤ļĀżņÜ┤ ĒÖśņ×ÉļōżņØ┤ ņ╣śļŻīĻ░Ć ļīĆņāüņØ┤ ļÉĀ ņłś ņ׳ļŗż[20].
ļ│Ė ņŚ░ĻĄ¼ņŚÉ ņé¼ņÜ®ļÉ£ NaF ļ░öļŗłņē¼ņÖĆ SDFņÖĆ Ļ░ÖņØĆ ĻĄŁņåī ļČłņåīņĀ£ļŖö ņ×¼Ļ┤æĒÖö ļ░Å ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ ĻĖ░ļīĆĒĢśļ®░ ņśłļ░®ņĀü ņ▓śņ╣śņĀ£ņ£╝ļĪ£ ņé¼ņÜ®ļÉśļ®░[23], ļ»ĖĻĄŁņ╣śĻ│╝ņØśņé¼ĒśæĒÜīļŖö ICDAS(International Caries Detection and Assessment System) 1~2 ņłśņżĆņØś Ēæ£ļ®┤ņÜ░ņŗØņŚÉļŖö ļČłņåī ļ░öļŗłņē¼ļź╝ ICDAS 5~6 ņłśņżĆņØś ņÖĆļÅÖņØ┤ ĒśĢņä▒ļÉ£ ņÜ░ņŗØņØ┤ļéś ņ╣śĻĘ╝ņÜ░ņŗØņŚÉļŖö SDFļź╝ ļÅäĒżĒĢśļÅäļĪØ ĻČīņןĒĢśĻ│Ā ņ׳ļŗż[20]. ņØ╝ļ░śņĀüņ£╝ļĪ£ ņé¼ņÜ®ļÉśļŖö 5% NaF ļ░öļŗłņē¼ļŖö 22,600ppmņØś ļČłņåīļź╝ ĒżĒĢ©ĒĢśļŖö ļ░śļ®┤, 38% SDFļŖö 44,800ppmņØś ļČłņåīļź╝ ĒżĒĢ©ĒĢ£ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ SDF ļ░Å SDF/PI ĻĘĖļŻ╣ņØ┤ NaF ĻĘĖļŻ╣ļ│┤ļŗż ļŹö Ļ░ĢĒĢ£ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ ļ│┤ņśĆļŖöļŹ░, ņØ┤ļź╝ ļåÆņØĆ ļČłņåī ļåŹļÅäļĪ£ ņØ┤ĒĢ┤ĒĢĀ ņłś ņ׳ņ£╝ļéś NaFņØś ņÜ░ņŗØ ņ¢ĄņĀ£ ļ░Å ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļŖö ņØ╝ņŗ£ņĀüņØ┤ļ®░, SDFņØś ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļŖö ņŻ╝ļĪ£ ņØĆ ņØ┤ņś©ņŚÉ ņØśĒĢ£ Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[9]. 38% SDF ņÜ®ņĢĪņØĆ ņĢĮ 253,870ppmņØś ņØĆ ņØ┤ņś©ņØä ĒżĒĢ©ĒĢśļ®░[7], ņØĆ ņØ┤ņś©ņØĆ ļŗżņØīĻ│╝ Ļ░ÖņØĆ ļ®öņ╗żļŗłņ”śņØä ĒåĄĒĢ┤ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļéĖļŗż. ņ▓½ņ¦Ė, ļ░ĢĒģīļ”¼ņĢäņØś ņĀäņ×É ņĀäļŗ¼ ņŗ£ņŖżĒģ£ņØä ņ¢ĄņĀ£ĒĢśĻ│Ā ļ░ĢĒģīļ”¼ņĢä ņāØņĪ┤ņŚÉ ĒĢäņłśņĀüņØĖ ĒÜ©ņåīņØś Ēŗ░ņś¼ ĻĘĖļŻ╣ņŚÉ Ļ▓░ĒĢ®ĒĢśņŚ¼ ĒÜ©ņåī ĻĖ░ļŖźņØä ļ░®ĒĢ┤ĒĢ£ļŗż[24,25]. ļæśņ¦Ė, ļ░ĢĒģīļ”¼ņĢä ņäĖĒżļ¦ēņØś ņØīņĀäĒĢś ņśüņŚŁĻ│╝ ņāüĒśĖ ņ×æņÜ®ĒĢśņŚ¼ ņĀĢņĀäĻĖ░ ĻĘĀĒśĢņØä ļ░®ĒĢ┤ĒĢśĻ│Ā ļ░ĢĒģīļ”¼ņĢäņØś ņøĆņ¦üņ×äņØä ņĀĆĒĢ┤ĒĢśļ®░ ņäĖĒżļ¦ēņØä ņåÉņāüņŗ£Ēé©ļŗż[26]. ņģŗņ¦Ė, ļ░ĢĒģīļ”¼ņĢä DNAņŚÉ Ļ▓░ĒĢ®ĒĢśņŚ¼ DNA ļ│ĆņØ┤ņÖĆ ņäĖĒż ņé¼ļ®ĖņØä ņ£ĀļÅäĒĢ£ļŗż[25]. ņØ┤ļ¤¼ĒĢ£ ļŗżņżæ ļ®öņ╗żļŗłņ”śņ£╝ļĪ£ ņØĖĒĢ┤ ļ░ĢĒģīļ”¼ņĢäļŖö ņØĆ ņØ┤ņś©ņŚÉ ļīĆĒĢ£ ļé┤ņä▒ņØä ļ░£ļŗ¼ņŗ£ĒéżĻĖ░ ņ¢┤ļĀĄļŗż. ļśÉĒĢ£, ņØĆ ņØ┤ņś©ņØĆ ņāüņĢäņ¦ł ļé┤ņØś ņŻĮņØĆ ļ░ĢĒģīļ”¼ņĢäņŚÉ ņĀĆņןļÉśņ¢┤ ņ׳ļŗżĻ░Ć ņé┤ņĢäņ׳ļŖö ļ░ĢĒģīļ”¼ņĢäĻ░Ć ļÅäņ×ģļÉśļ®┤ ņ×¼ĒÖ£ņä▒ĒÖöļÉśĻ│Ā ņ¦ĆņåŹņĀüņØĖ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļéĖļŗż[8,9]. ļö░ļØ╝ņä£ SDFļŖö NaFņÖĆ Ļ░ÖņØĆ ļČłņåī ĻĖ░ļ░śĒĢ£ ļ░öļŗłņē¼ņŚÉ ļ╣äĒĢ┤ ņÜ░ņłśĒĢ£ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ ļ│┤ņØ┤ļ®░ ņ╣śņĢä ņÜ░ņŗØņØś ņśłļ░®Ļ│╝ ņ¢ĄņĀ£ņŚÉ ļŹöņÜ▒ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņé¼ņÜ®ļÉĀ ņłś ņ׳ļŗż. ĒĢ£ĒÄĖ, SDF ņé¼ņÜ®ņØś Ļ░Ćņן ņØ╝ļ░śņĀüņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśļŖö ļČĆņ×æņÜ®ņØĆ ņÜ░ņŗØ ļ│æņåīņØś Ļ▓ĆņØĆ ņ░®ņāēņØ┤ļŗż. ņØ┤ļŖö SDFĻ░Ć ņ╣śņĢäņŚÉ ņĀüņÜ®ļÉĀ ļĢī ņØĖņé░ņØĆņØä ĒśĢņä▒ĒĢśĻĖ░ ļĢīļ¼ĖņØ┤ļŗż[27]. ņØ┤ ņ░®ņāē ļ¼ĖņĀ£ļź╝ SDF ņé¼ņÜ® Ēøä PIļź╝ ņĀüņÜ®ĒĢ©ņ£╝ļĪ£ņŹ© ĒĢ┤Ļ▓░ĒĢĀ ņłś ņ׳ļŗż. PIņÖĆņØś ļ░śņØæņ£╝ļĪ£ ņØĖņé░ņØĆņØ┤ ļ░▒ņāē ļČäļ¦ÉņØĖ ņé╝ņØĖņé░ņ╣╝ļź©ņ£╝ļĪ£ ļ│ĆĒĢśņŚ¼ ļ│ĆņāēņØä ņżäņØ┤ļŖö ņŚŁĒĢĀņØä ĒĢ£ļŗż[27]. ņØ╝ļČĆ ņŚ░ĻĄ¼ņŚÉņä£ļŖö PIĻ░Ć ņØĆ ņØ┤ņś©ņØś ņłśļź╝ ņżäņ×äņ£╝ļĪ£ņŹ© SDFņØś ĒĢŁņÜ░ņŗØ ĒÜ©Ļ│╝ļź╝ Ļ░Éņåīņŗ£Ēé©ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż[12,28]. ĻĘĖļ¤¼ļéś ļ│Ė ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņŚÉ ļö░ļź┤ļ®┤, SDFļź╝ PIņÖĆ ĒĢ©Ļ╗ś ņé¼ņÜ®ĒĢśļŹöļØ╝ļÅä NaFļ│┤ļŗż ņÜ░ņøöĒĢ£ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļé┤ļ®░ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ļ░ĢĒģīļ”¼ņĢäļź╝ ņĀ£Ļ▒░ĒĢśļŖö Ļ▓āņØä Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņŚłļŗż. ņØ┤ļŖö Sorkhdini ļō▒(2021) [29]ņØś ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņÖĆ ņØ╝ņ╣śĒĢ£ļŗż.
ĒāłĒÜīļÉ£ ņāüņĢäņ¦łņØś Ļ▓ĮļÅäļŖö SDF/PI ņĀüņÜ®ņ£╝ļĪ£ ņ”ØĻ░ĆĒĢśņśĆņ£╝ļ®░, 1ņŻ╝ņØ╝ ļÅÖņĢł ņØĖĻ│Ą ĒāĆņĢĪņŚÉ ļģĖņČ£ļÉ£ Ēøä ņ£ĀņØśĒĢ£ ņ”ØĻ░ĆĻ░Ć Ļ┤Ćņ░░ļÉśņŚłļŗż. ņÜ░ņŗØ ļ│æņåī Ēæ£ļ®┤ņŚÉņä£ Ļ┤Ćņ░░ļÉ£ Ēæ£ļ®┤Ļ▓ĮļÅäņØś ņ”ØĻ░ĆļŖö ņ×¼Ļ┤æĒÖö ĒÜ©Ļ│╝ļź╝ ļ░śņśüĒĢ£ļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļŖö SDFĻ░Ć ņÜ░ņŗØ ņāüņĢäņ¦łņŚÉņä£ ņ×¼Ļ┤æĒÖöļź╝ ņ┤ēņ¦äĒ¢łņØīņØä ņŗ£ņé¼ĒĢśļ®░, ņØ┤ļŖö ChuņÖĆ Lo(2008) [30], Mei ļō▒(2013) [31]ņØś ņäĀĒ¢ēņŚ░ĻĄ¼ņÖĆ ņØ╝ņ╣śĒĢ£ļŗż. ņāüņĢäņ¦ł ļ»ĖņäĖĻ▓ĮļÅäņØś ļ│ĆĒÖöļŖö ĻĘĖ ļ»Ėļäżļ×ä ĒĢ©ļ¤ēĻ│╝ ņ¦üņĀæņĀüņØĖ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŗż[32,33]. ņāüņĢäņ¦ł ļé┤ņØś ļ»Ėļäżļ×ä ĒĢ©ļ¤ēņØĆ ļ░ĢĒģīļ”¼ņĢä ņé░ņØś ņ╣©Ēł¼ļź╝ ņĀ£ĒĢ£ĒĢśļŖö ņןļ▓Į ņŚŁĒĢĀņØä ĒĢśļ®░, ĻĘĖ ņÖäņČ® ļŖźļĀźņØĆ ņ╣śņĢäņŚÉ ņ╣©Ēł¼ĒĢśļŖö ņé░ņØä ņżæĒÖöĒĢśļŖö ņŚŁĒĢĀņØä ĒĢ£ļŗż[34]. SDFņØś ņĀüņÜ®ņØĆ ļČłņåīņØś ņĪ┤ņ×¼ļĪ£ ņØĖĒĢ┤ ļ»Ėļäżļ×ä ĒĢ©ļ¤ēņØä ņ”ØĻ░Ćņŗ£Ēé©ļŗż. ņłśņé░ĒÖöņØĖĒÜīņäØņØś ņłśņé░ĻĖ░Ļ░Ć ļČłņåīļĪ£ ļīĆņ▓┤ļÉśņ¢┤ ĒśĢņä▒ļÉśļŖö ļČłĒÖöņØĖĒÜīņäØņØĆ ĒÖöĒĢÖņĀüņ£╝ļĪ£ ļ¦żņÜ░ ņĢłņĀĢņĀüņØ┤ļ®░ ņé░ņŚÉ ļīĆĒĢ£ ņĀĆĒĢŁņä▒ņØ┤ ņ”ØĻ░ĆĒĢ£ļŗż. SDFļŖö ņĢīņ╣╝ļ”¼ņä▒ņØ┤ļ®░, ĻĘĖ ļåÆņØĆ ņĢīņ╣╝ļ”¼ņä▒ņØĆ ņØ┤ņś© ĻĄÉĒÖśņŚÉ ņØ┤ņāüņĀüņØĖ ņĪ░Ļ▒┤ņØä ļ¦īļōżņ¢┤ Ēæ£ļ®┤ ļČłĒÖöņØĖĒÜīņäØņØś ĒśĢņä▒ņØä ņ┤ēņ¦äĒĢ£ļŗż[2,31]. ĒŖ╣Ē׳, Mei ļō▒(2013) [31]ņØĆ Ēæ£ļ®┤ņĖĄņØś ņ╣╝ņŖśĻ│╝ ņØĖ ĒĢ©ļ¤ēņØĆ ņÜ░ņŗØņØś ņśüĒ¢źņØä ļ░øņ¦Ć ņĢŖņØĆ ļé┤ļČĆ ņāüņĢäņ¦łļ│┤ļŗż ļŹö ļåÆņĢśņØīņØä ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░, SDFņŚÉ ņØśĒĢ┤ ņ£ĀļÅäļÉ£ ņĀĢņ¦ĆļÉ£ ņÜ░ņŗØ ļ│æņåīļŖö ĒÖ£ņä▒ ņÜ░ņŗØ ļ│æņåīņŚÉ ļ╣äĒĢ┤ ņל ņĪ░ņ¦üĒÖöļÉ£ Ļ▓░ņĀĢ ĻĄ¼ņĪ░ņĖĄņØä Ļ┤Ćņ░░ĒĢśņśĆļŗż. Yu ļō▒(2018) [35]ļÅä SDFņØś ņé¼ņÜ®ņØ┤ Ļ┤æĒÖöļÉ£ Ēæ£ļ®┤ņØś XRD Ēī©Ēä┤ņŚÉņä£ ļČłņÜ®ņä▒ ņŚ╝ĒÖöņØĆņØ┤ ĒśĢņä▒ļÉśņŚłļŗżĻ│Ā ļ│┤Ļ│ĀĒ¢łļŗż. SDFņŚÉ ņØśĒĢ┤ ļ│ĆĒÖöļÉ£ Ļ░ÉņŚ╝ņāüņĢäņ¦łņØś Ēæ£ļ®┤ ĻĄ¼ņĪ░ļŖö ļ│┤ĒśĖ ņĖĄ ņŚŁĒĢĀņØä ĒĢśļ®░ ĒāłĒÜīļÉ£ ņāüņĢäņ¦łņŚÉņä£ ņ╣╝ņŖśĻ│╝ ņØĖņØś ņČöĻ░Ć ņåÉņŗżņØä ļ░®ņ¦ĆĒĢ£ļŗż[30].
ļ│Ė ņŚ░ĻĄ¼ļŖö RMGIņØś ņāüņĢäņ¦łĒæ£ļ®┤ ņĀæņ░®ņØś ņ×äņāü ņĪ░Ļ▒┤ņØä ņ×¼ĒśäĒĢśĻĖ░ ņ£äĒĢ┤ ļ¬ćĻ░Ćņ¦Ć ļģĖļĀźņØä ĻĖ░ņÜĖņśĆļŗż. ņ▓½ņ¦Ė, SDFļĪ£ ņ▓śļ”¼ĒĢ£ ĒāłĒÜī ņāüņĢäņ¦ł ņŗ£ĒÄĖņØä 7ņØ╝ ļÅÖņĢł ņØĖĻ│Ą ĒāĆņĢĪņŚÉ ņ╣©ņĀäņŗ£ņ╝░ļŗż. ļæśņ¦Ė, Ļ▓░ĒĢ® ļé┤ĻĄ¼ņä▒ņØä ĒÅēĻ░ĆĒĢśĻĖ░ ņ£äĒĢ┤ ņŚ┤ņł£ĒÖś Ļ│╝ņĀĢņØä ņłśĒ¢ēĒ¢łļŗż. ĒśäņŗżņĀüņØĖ Ļ▓░ĒĢ® Ļ░ĢļÅäņØś ļé┤ĻĄ¼ņä▒ņØä ņŗżĒŚśņŗż ņāüņŚÉņä£ ĒÅēĻ░ĆĒĢśĻĖ░ ņ£äĒĢ£ Ļ░Ćņן ņØ╝ļ░śņĀüņØĖ ļ░®ļ▓ĢņØĆ ņŚ┤ņł£ĒÖśņ▓śļ”¼ ļśÉļŖö ņןĻĖ░ņłśņżæ ļ│┤Ļ┤ĆņØ┤ļŗż. ņØ┤ņżæ ņŚ┤ņł£ĒÖśņØĆ Ļ▓░ĒĢ® Ļ░ĢļÅä ņŚ░ĻĄ¼ņŚÉņä£ ņŚ┤ Ēö╝ļĪ£ļź╝ ņŗ£ļ«¼ļĀłņØ┤ņģśĒĢśĻĖ░ ņ£äĒĢ┤ ņØ╝ļ░śņĀüņ£╝ļĪ£ ņé¼ņÜ®ļÉśļŖöļŹ░[36], ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ¬©ļōĀ ņŗ£ĒÄĖņØä 5000ĒÜī ņŚ┤ņł£ĒÖśĒĢśņśĆņ£╝ļ®░, ņØ┤ļŖö ņĢĮ 6Ļ░£ņøöņØś ņ×äņāü ņĪ░Ļ▒┤ņØä ņØśļ»ĖĒĢ£ļŗż[37,38]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņÜ░ņŗØņāüņĢäņ¦ł Ēæ£ļ®┤Ļ│╝ SDF/PIļź╝ ņ▓śļ”¼ĒĢ£ ņÜ░ņŗØ ņāüņĢäņ¦ł Ēæ£ļ®┤ņŚÉ ņĀæņ░®ĒĢ£ RMGIņØś Ļ▓░ĒĢ® Ļ░ĢļÅäņŚÉļŖö ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŖöļŹ░, ņØ┤ļŖö ĒÅ┤ļ”¼ņĢīņ╝ĆļģĖņé░ ņ▓┤ņØĖņØś ņØīņØ┤ņś©Ļ│╝ ņłśņé░ĒÖöņØĖĒÜīņäØņØś ņ╣╝ņŖś ņØ┤ņś© ņé¼ņØ┤ņØś ĒÖöĒĢÖņĀü Ļ▓░ĒĢ®[39~41]Ļ│╝ ņāüņĢäņ¦ł Ļ▓░ĒĢ®ņĀ£ņÖĆ ņāüņĢäņ¦ł ņé¼ņØ┤ņŚÉ ņØ╝ņ¢┤ļéśļŖö Ļ▓āĻ│╝ ņ£Āņé¼ĒĢ£ ļ»ĖņäĖĻĖ░Ļ│äņĀü Ļ▓░ĒĢ®[42~45]ņØ┤ SDF/PIļź╝ ņ▓śļ”¼ĒĢ£ Ēæ£ļ®┤ ņĀæņ░®ņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ņłśĒ¢ēĒĢśĻ│Ā ņ׳ņØīņØä ņŗ£ņé¼ĒĢ£ļŗż[41,46]. ĒØźļ»ĖļĪŁĻ▓īļÅä, SDF/PI ņĀüņÜ® 1ņŻ╝ņØ╝ Ēøä RMGIļź╝ ņĀæņ░®ĒĢ£ ĻĄ░ņØś Ļ▓░ĒĢ® Ļ░ĢļÅäļŖö ņ£ĀņØśņä▒ ņ׳Ļ▓ī ņ”ØĻ░ĆĒĢśņśĆļŗż. Ng ļō▒(2020) [47]ņØĆ SDF Ēæ£ļ®┤ņ▓śļ”¼ņÖĆ ņłśļ│Ąņ╣śļŻīņØä ļŗ╣ņØ╝ņŚÉ ļ¬©ļæÉ ņŗ£Ē¢ēĒĢśņ¦Ć ņĢŖĻ│Ā 2ĒÜīļĪ£ ļČäļ”¼ĒĢśņŚ¼ ņ╣śļŻīĒĢśļ®┤ ņĄ£ņóģ ņłśļ│Ąļ¼╝ņØś ņĀäļŗ© Ļ▓░ĒĢ® Ļ░ĢļÅäļź╝ Ē¢źņāüņŗ£Ēé¼ ņłś ņ׳ļŗżĻ│Ā ņĀ£ņŗ£Ē¢łļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļŖö SDFĻ░Ć ņČ®ļČäĒ׳ ņ×æņÜ®ĒĢĀ ņłś ņ׳ļŖö ņŗ£Ļ░äņØä ĒÖĢļ│┤ĒĢ©ņ£╝ļĪ£ņŹ© ĒĢ┤ļŗ╣ ĻĖ░Ļ░ä ļÅÖņĢł SDFņØś ņØĆ ņØ┤ņś©ņØ┤ ņāüņĢäņäĖĻ┤Ćņ£╝ļĪ£ ļŹö Ļ┤æļ▓öņ£äĒĢśĻ▓ī ņ╣©Ēł¼ĒĢĀ ņłś ņ׳ļŗżļŖö ņé¼ņŗżņØä ĻĘ╝Ļ▒░ļĪ£ĒĢ£ļŗż[14,47,48]. ņØĆ ņØ┤ņś©ņØĆ ņāüņĢäņ¦ł ņĮ£ļØ╝Ļ▓É ĻĖ░ņ¦ł ļŗ©ļ░▒ņ¦łņØä ļČäĒĢ┤ĒĢśņŚ¼ Ļ▓░ĒĢ® ņåÉņŗżņØä ņØ╝ņ£╝ĒéżļŖö MMPsņÖĆ ņŗ£ņŖżĒģīņØĖ ņ╣┤ĒģØņŗĀ(cysteine cathepsins)ĒÜ©ņåīļź╝ ņ¢ĄņĀ£ĒĢśļŖö ĒÜ©Ļ│╝Ļ░Ć ņ׳ļŗż[9,49,50]. SDF/PI Ēæ£ļ®┤ņ▓śļ”¼ņÖĆ RMGIņłśļ│ĄņØś Ļ░äĻ▓®ņØ┤ 1ņŻ╝ņØ╝ Ļ░äĻ▓®ņØ┤ ņ׳ņØä ļĢī Ļ▓░ĒĢ® Ļ░ĢļÅäĻ░Ć ņ”ØĻ░ĆĒĢ£ Ļ▓░Ļ│╝ļŖö, SDFņ▓śļ”¼ Ēøä ņ”ēņØ╝ RMGIļź╝ ņłśļ│ĄĒĢśļŖö Ļ▓āņØ┤ ņĢäļŗłļØ╝, ņØ╝ņŻ╝ņØ╝ Ēøä ņĀĢļÅäņØś ļŗżņØī ļé┤ņøÉņŚÉ ņŗ£Ē¢ēĒĢśļŖö Ļ▓āņØ┤ ņ×äņāü Ļ▓░Ļ│╝ļź╝ ņóŗĻ▓ī ĒĢ£ļŗżļŖö Ļ▓āņØä ņŗ£ņé¼ĒĢ£ļŗż.
ļ│Ė ņŚ░ĻĄ¼ņØś Ļ▓░Ļ│╝ļź╝ ņ×äņāüņŚÉ ņĀüņÜ®ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö SDF/PIņØś ĻĄ¼ņ▓┤ņĀüņØĖ ņé¼ņÜ® ļ░®ļ▓ĢĻ│╝ ņŻ╝ņØśņé¼ĒĢŁņØä ņØ┤ĒĢ┤ĒĢśļŖö Ļ▓āņØ┤ ņżæņÜöĒĢśļŗż. ņ×äņāüņŚÉņä£ SDF/PIļź╝ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņé¼ņÜ®ĒĢśĻĖ░ ņ£äĒĢ£ Ļ░ĆņØ┤ļō£ļØ╝ņØĖņØĆ ļŗżņØīĻ│╝ Ļ░Öļŗż:
o SDF: ņ╣śņĢäņŚÉ ņČ®ļČäĒ׳ ĒØĪņłśļÉĀ ņłś ņ׳ļÅäļĪØ ņĄ£ņåī 1ļČäĻ░ä ņĀüņÜ®ĒĢ£ļŗż. ņØ┤ļŖö ļ¬©ņäĖĻ┤Ć ĒśäņāüņØä ĒåĄĒĢ┤ SDFĻ░Ć ņ╣śņĢä ĻĄ¼ņĪ░ ļé┤ļĪ£ ņ╣©Ēł¼ĒĢśļŖö ļŹ░ ĒĢäņÜöĒĢ£ ņŗ£Ļ░äņØ┤ļŗż.
o PI: SDF ņĀüņÜ® ņ¦üĒøä ņĀüņÜ®ĒĢśļ®░, ļŹö ņØ┤ņāü ĒØ░ņāē ņ╣©ņĀäļ¼╝ņØ┤ ņāØĻĖ░ņ¦Ć ņĢŖņØä ļĢīĻ╣īņ¦Ć 1~3ĒÜī ļ░śļ│Ą ņĀüņÜ®ĒĢ£ļŗż. ņØ┤ļŖö ņØĆ ņØ┤ņś©Ļ│╝ ņÜöņśżļō£ ņØ┤ņś©ņØś ļ░śņØæņØä ņÖäļŻīĒĢśņŚ¼ ņ░®ņāēņØä ņĄ£ņåīĒÖö ĒĢśĻĖ░ ņ£äĒĢ©ņØ┤ļŗż.
o ļŗżļ░£ņä▒ ņÜ░ņŗØņØ┤ļéś ņ╣śĻĘ╝ ņÜ░ņŗØĻ│╝ Ļ░ÖņØ┤ ņ”ēĻ░üņĀüņØĖ ņłśļ│ĄņØ┤ ņ¢┤ļĀżņÜ┤ Ļ▓ĮņÜ░, SDF/PI ņĀüņÜ® 2~4ņŻ╝ Ēøä ņ×¼ĒÅēĻ░Ćļź╝ ņŗżņŗ£ĒĢ£ļŗż. ņØ┤ļĢī ļüØņØ┤ ļŁēĒłŁĒĢ£ ĒāÉņ╣©(ball-ended probe)ņØä ņé¼ņÜ®ĒĢśņŚ¼ ļ│æļ│ĆņØś Ļ▓ĮļÅäļź╝ ĒÖĢņØĖĒĢ£ļŗż. ņŚ¼ņĀäĒ׳ ļ│æļ│ĆņØ┤ ļČĆļō£ļ¤Įļŗżļ®┤ SDF/PIļź╝ ņ×¼ņĀüņÜ®ĒĢ£ļŗż.
o ņÖĆļÅÖņØ┤ ĒśĢņä▒ļÉ£(cavitated) ņÜ░ņŗØņØś Ļ▓ĮņÜ░, SDF/PI ņĀüņÜ® Ēøä ņĀüņĀłĒĢ£ ņłśļ│Ą ņ×¼ļŻīļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņłśļ│ĄĒĢśļŖö Ļ▓āņØ┤ ĻČīņןļÉ£ļŗż. ļ│Ė ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņŚÉ ļö░ļź┤ļ®┤, SDF/PI ņĀüņÜ® 1ņŻ╝ņØ╝ Ēøä RMGIļĪ£ ņłśļ│ĄĒĢśļŖö Ļ▓āņØ┤ Ļ▓░ĒĢ® Ļ░ĢļÅä ņĖĪļ®┤ņŚÉņä£ ņ£Āļ”¼ĒĢĀ ņłś ņ׳ļŗż.
o SDFņŚÉ ĒżĒĢ©ļÉ£ ņØĆņŚÉ ļīĆĒĢ£ ņĢīļĀłļź┤ĻĖ░ Ļ░ĆļŖźņä▒ņØä ņé¼ņĀäņŚÉ ĒÖĢņØĖĒĢ┤ņĢ╝ ĒĢ£ļŗż. ņØĆ ņĢīļĀłļź┤ĻĖ░Ļ░Ć ņ׳ļŖö ĒÖśņ×ÉņØś Ļ▓ĮņÜ░ ļīĆņ▓┤ ņ╣śļŻīļ▓ĢņØä Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢ£ļŗż.
o PI ņÜ®ņĢĪņØĆ Ēā£ņĢäņŚÉ ņ£ĀĒĢ┤ĒĢĀ ņłś ņ׳ņ£╝ļ»ĆļĪ£ ņ×äņŗĀ ļ░Å ņłśņ£Ā ņżæņØĖ ņŚ¼ņä▒ņŚÉĻ▓īļŖö ĻĖłĻĖ░ ņé¼ĒĢŁņ×äņØä ļ¬ģĒÖĢĒ׳ ņäżļ¬ģĒĢ£ļŗż. ņØ┤ļ¤¼ĒĢ£ ĒÖśņ×ÉĻĄ░ņŚÉĻ▓īļŖö ļīĆņ▓┤ ņ╣śļŻīļ▓ĢņØä ņĀ£ņŗ£ĒĢ┤ņĢ╝ ĒĢ£ļŗż.
o SDF ņĀüņÜ® ņŗ£ ņŻ╝ļ│Ć ņŚ░ņĪ░ņ¦ü ļ│┤ĒśĖņØś ņżæņÜöņä▒ņØä ņäżļ¬ģĒĢ£ļŗż. ļ¤¼ļ▓äļīÉņØ┤ļéś ļ░öņäĖļ”░ ļō▒ņ£╝ļĪ£ ņŻ╝ļ│Ć ņĪ░ņ¦üņØä ņĀüņĀłĒ׳ ļ│┤ĒśĖĒĢśņ¦Ć ļ¬╗Ē¢łņØä Ļ▓ĮņÜ░, ņØ╝ņŗ£ņĀüņØĖ ĻČżņ¢æņä▒ ņ╣śņØĆņŚ╝ņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳ņØīņØä ĒÖśņ×ÉņÖĆ ļ│┤ĒśĖņ×ÉņŚÉĻ▓ī ļ»Ėļ”¼ Ļ│Āņ¦ĆĒĢ£ļŗż. ņØ┤ļ¤¼ĒĢ£ ņ”ØņāüņØĆ ņØ╝ļ░śņĀüņ£╝ļĪ£ 48ņŗ£Ļ░ä ļé┤ņŚÉ ņ×ÉņŚ░ ņ╣śņ£ĀļÉ£ļŗż
o SDF/PI ņĀüņÜ® Ēøä ņĀĢĻĖ░ņĀüņØĖ follow-upņØ┤ ņżæņÜöĒĢ©ņØä Ļ░ĢņĪ░ĒĢ£ļŗż. ņ┤łĻĖ░ņŚÉļŖö 2~4ņŻ╝ Ļ░äĻ▓®ņ£╝ļĪ£, ņØ┤ĒøäņŚÉļŖö 3~6Ļ░£ņøö Ļ░äĻ▓®ņ£╝ļĪ£ ņ×¼ĒÅēĻ░Ćļź╝ ņŗżņŗ£ĒĢśņŚ¼ ņÜ░ņŗØņØś ņ¦äĒ¢ē ņŚ¼ļČĆļź╝ ļ¬©ļŗłĒä░ļ¦üĒĢ£ļŗż.
o ĒÖśņ×ÉņØś ĻĄ¼Ļ░Ģ ņ£äņāØ Ļ┤Ćļ”¼ ļŖźļĀźĻ│╝ ņŗØņØ┤ ņŖĄĻ┤ĆņŚÉ ļö░ļØ╝ ņ×¼ņĀüņÜ® ņŻ╝ĻĖ░ļź╝ ņĪ░ņĀłĒĢĀ ņłś ņ׳ļŗż. Ļ│Āņ£äĒŚśĻĄ░ ĒÖśņ×ÉņØś Ļ▓ĮņÜ░ ļŹö ņ¦¦ņØĆ Ļ░äĻ▓®ņ£╝ļĪ£ ņ×¼ņĀüņÜ®ņØä Ļ│ĀļĀżĒĢĀ ņłś ņ׳ļŗż.
ņØ┤ļ¤¼ĒĢ£ ņ×äņāü ņĀüņÜ® Ļ░ĆņØ┤ļō£ļØ╝ņØĖņØä ĒåĄĒĢ┤ ņ╣śĻ│╝ ņØśņé¼ļōżņØĆ ļ│Ė ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļź╝ ņŗżņĀ£ ņ¦äļŻī ĒÖśĻ▓ĮņŚÉ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņĀüņÜ®ĒĢĀ ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż. SDF/PIņØś ņĀüņĀłĒĢ£ ņé¼ņÜ®ņØĆ ĒŖ╣Ē׳ Ē¢ēļÅÖ ņĪ░ņĀłņØ┤ ņ¢┤ļĀżņÜ┤ ņåīņĢä ĒÖśņ×É, ņןņĢĀņØĖ ĒÖśņ×É, ļśÉļŖö Ļ│ĀļĀ╣ ĒÖśņ×É ļō▒ ņĀäĒåĄņĀüņØĖ ņ╣śĻ│╝ ņ╣śļŻīĻ░Ć ņ¢┤ļĀżņÜ┤ ĒÖśņ×ÉĻĄ░ņŚÉņä£ ņÜ░ņŗØ Ļ┤Ćļ”¼ņØś ņāłļĪ£ņÜ┤ ļīĆņĢłņØ┤ ļÉĀ ņłś ņ׳ļŗż. ļśÉĒĢ£, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ĒÖĢņØĖļÉ£ SDF/PIņØś ĒĢŁĻĘĀ ĒÜ©Ļ│╝ņÖĆ ņ×¼Ļ┤æĒÖö ņ┤ēņ¦ä ĒÜ©Ļ│╝ļŖö ņśłļ░®ņĀü ņĖĪļ®┤ņŚÉņä£ļÅä Ēü░ Ļ░Ćņ╣śĻ░Ć ņ׳ņ£╝ļ»ĆļĪ£, Ļ│Āņ£äĒŚśĻĄ░ ĒÖśņ×ÉņØś ņÜ░ņŗØ ņśłļ░® ĒöäļĪ£ĻĘĖļשņŚÉļÅä ņĀüĻĘ╣ņĀüņ£╝ļĪ£ ĒÖ£ņÜ®ļÉĀ ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż.
ACKNOWLEDGEMENTS
The artificial saliva used in this study was prepared with the assistance of Professor Sung-Hoon Lee from the Department of Microbiology, Dankook University College of Dentistry.
Figure┬Ā2.
ņØĖĻ│Ą ņÜ░ņŗØņØä ĒśĢņä▒ĒĢ£ ņāüņĢäņ¦ł Ēæ£ļ®┤ņŚÉņä£ Ļ▓ĆņČ£ļÉ£ Str eptococcus mutansņØś CFU ņłś.
ņ¢┤ļ¢ĀĒĢ£ ņ▓śņ╣śļź╝ ĒĢśņ¦Ć ņĢŖņØĆ ņØĖĻ│ĄņÜ░ņŗØ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤, SDF/PI, SDF, NaF ĻĘĖļŻ╣ņŚÉņä£ ņ£ĀņØśņä▒ ņ׳ļŖö Streptococcus mutansņØś Ļ░Éņåīļź╝ ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż(p < 0.05). SDF Ēæ£ļ®┤ņ▓śļ”¼ļź╝ ĒĢ£ ĻĘĖļŻ╣ņØĆ PIņÜ®ņĢĪņØś ņČöĻ░Ć ņ▓śļ”¼ņÖĆ Ļ┤ĆĻ│äņŚåņØ┤ NaF ļ░öļŗłņē¼ ĻĘĖļŻ╣ļ│┤ļŗż ņÜ░ņłśĒĢ£ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ ļ│┤ņśĆļŗż.
Figure┬Ā3.
ĒāłĒÜī ļ░Å SDF/PI ņ▓śļ”¼ Ēøä ņāüņĢäņ¦ł Ēæ£ļ®┤ņØś ļ╣äņ╗żņŖż ļ»ĖņäĖĻ▓ĮļÅä(VHN).
ņāüņĢäņ¦ł Ēæ£ļ®┤ņŚÉ ņØĖĻ│ĄņÜ░ņŗØņØä ĒśĢņä▒Ē¢łņØä Ļ▓ĮņÜ░ Ēæ£ļ®┤Ļ▓ĮļÅäņØś Ēü░ ĒĢśļØĮņØ┤ ņ׳ņŚłņ£╝ļéś, ĒĢ┤ļŗ╣ Ēæ£ļ®┤ņŚÉ SDF/PIļź╝ ņĀüņÜ®ĒĢ£ ņ¦üĒøä VHNņŚÉļŖö ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. ĻĘĖļ¤¼ļéś SDF/PI ņĀüņÜ® 1ņŻ╝ņØ╝ Ēøä Ēæ£ļ®┤ņØĆ ņØĖĻ│ĄņÜ░ņŗØņØä ņāØņä▒ĒĢ£ ņ┤łĻĖ░ Ēæ£ļ®┤ņŚÉ ļ╣äĒĢ┤ VHNņØ┤ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒ¢łļŗż(p<0.05).

Figure┬Ā4.
ĒāłĒÜī ļ░Å SDF/PI ņ▓śļ”¼ Ēøä ņāüņĢäņ¦ł Ēæ£ļ®┤ņØś ņĀäļŗ© Ļ▓░ĒĢ® Ļ░ĢļÅä(Shear Bond Setrngth).
ņØĖĻ│Ą ņÜ░ņŗØņŚÉ SDF/PIļź╝ ņ▓śļ”¼ ņŚ¼ļČĆņÖĆ Ļ┤ĆļĀ©ņŚåņØ┤ RMGIļŖö ņ£Āņé¼ĒĢ£ Ļ▓░ĒĢ® Ļ░ĢļÅäļź╝ ļ│┤ņśĆļŗż. ņØĖĻ│Ą ņÜ░ņŗØņŚÉ SDF/PIļź╝ ņĀüņÜ®ĒĢ£ ņ¦Ć 1ņŻ╝ņØ╝ Ēøä, RMGIņØś Ļ▓░ĒĢ® Ļ░ĢļÅäļŖö ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņśĆļŗż(p<0.05).
REFERENCES
1. Kassebaum NJ, Bernabe E, Dahiya M, Bhandari B, Murray CJ, Marcenes W. Global burden of untreated caries: A systematic review and metaregression. J Dent Res 2015;94(5):650ŌĆō658. https://doi.org/10.1177/0022034515573272.


2. Rosenblatt A, Stamford TC, Niederman R. Silver diamine fluoride: A caries "silver-fluoride bullet". J Dent Res 2009;88(2):116ŌĆō125. https://doi.org/10.1177/0022034508329406.


3. Song J-S. The effect of silver diamine fluoride in preventing dental caries. The Journal of The Korean Dental Association 2018;56(8):424ŌĆō431. https://doi.org/10.22974/jkda.2018.56.8.002.

4. Nishino M, Yoshida S, Sobue S, Kato J, Nishida M. Effect of topically applied ammoniacal silver fluoride on dental caries in children. J Osaka Univ Dent Sch 1969;9:149ŌĆō155.

5. Yamaga R, Nishino M, Yoshida S, Yokomizo I. Diammine silver fluoride and its clinical application. J Osaka Univ Dent Sch 1972;12:1ŌĆō20.

6. Zheng FM, Yan IG, Duangthip D, Gao SS, Lo ECM, Chu CH. Silver diamine fluoride therapy for dental care. The Japanese dental science review 2022;58:249ŌĆō257. https://doi.org/10.1016/j.jdsr.2022.08.001.



7. Mei ML, Lo EC, Chu CH. Clinical use of silver diamine fluoride in dental treatment. Compend Contin Educ Dent 2016;37(2):93ŌĆō98. quiz100.

8. Zhao IS, Gao SS, Hiraishi N, Burrow MF, Duangthip D, Mei ML et al. Mechanisms of silver diamine fluoride on arresting caries: A literature review. Int Dent J 2018;68(2):67ŌĆō76. https://doi.org/10.1111/idj.12320.


9. Mei ML, Li QL, Chu CH, Lo EC, Samaranayake LP. Antibacterial effects of silver diamine fluoride on multi-species cariogenic biofilm on caries. Ann Clin Microbiol Antimicrob 2013;12:4. https://doi.org/10.1186/1476-0711-12-4.



10. Seo M, Song J-S, Shin TJ, Hyun H-K, Kim J-W, Jang K-T et al. The effect of silver diamine fluoride on salivary biofilm. The Journal of the Korean Academy of Pedtatric Dentistry 2020;47(4):406ŌĆō415. https://doi.org/10.5933/jkapd.2020.47.4.406.

11. Kalsi AS, Bomfim DI, Hussain Z. Factors affecting decision making at reassessment of periodontitis. Part 4: Treatment options for residual periodontal pockets. Br Dent J 2019;227(11):967ŌĆō974. https://doi.org/10.1038/s41415-019-1000-5.


12. Hamama HH, Yiu CK, Burrow MF. Effect of silver diamine fluoride and potassium iodide on residual bacteria in dentinal tubules. Aust Dent J 2015;60(1):80ŌĆō87. https://doi.org/10.1111/adj.12276.


13. Zhao IS, Mei ML, Burrow MF, Lo EC, Chu CH. Effect of silver diamine fluoride and potassium iodide treatment on secondary caries prevention and tooth discolouration in cervical glass ionomer cement restoration. Int J Mol Sci 2017;18(2):https://doi.org/10.3390/ijms18020340.

14. Gupta J, Thomas MS, Radhakrishna M, Srikant N, Ginjupalli K. Effect of silver diamine fluoride-potassium iodide and 2% chlorhexidine gluconate cavity cleansers on the bond strength and microleakage of resin-modified glass ionomer cement. J Conserv Dent 2019;22(2):201ŌĆō206. https://doi.org/10.4103/JCD.JCD_485_18.



15. Contreras V, Toro MJ, Elias-Boneta AR, Encarnacion-Burgos A. Effectiveness of silver diamine fluoride in caries prevention and arrest: A systematic literature review. Gen Dent 2017;65(3):22ŌĆō29.


16. Gotjamanos T. Safety issues related to the use of silver fluoride in paediatric dentistry. Aust Dent J 1997;42(3):166ŌĆō168. https://doi.org/10.1111/j.1834-7819.1997.tb00115.x.


17. Oliveira BH, Rajendra A, Veitz-Keenan A, Niederman R. The effect of silver diamine fluoride in preventing caries in the primary dentition: A systematic review and meta-analysis. Caries Res 2019;53(1):24ŌĆō32. https://doi.org/10.1159/000488686.


18. Chu CH, Lo EC, Lin HC. Effectiveness of silver diamine fluoride and sodium fluoride varnish in arresting dentin caries in chinese pre-school children. J Dent Res 2002;81(11):767ŌĆō770. https://doi.org/10.1177/0810767.


19. Horst JA, Ellenikiotis H, Milgrom PL. Ucsf protocol for caries arrest using silver diamine fluoride: Rationale, indications and consent. J Calif Dent Assoc 2016;44(1):16ŌĆō28.



20. Slayton RL, Urquhart O, Araujo MWB, Fontana M, Guzman-Armstrong S, Nascimento MM et al. Evidence-based clinical practice guideline on nonrestorative treatments for carious lesions: A report from the american dental association. J Am Dent Assoc 2018;149(10):837ŌĆō849. e819. https://doi.org/10.1016/j.adaj.2018.07.002.


21. ņØ┤ņŖ╣Ēśä. ņČ®ņ╣śņ×ĪļŖö ņ┤ØņĢī. ņ╣śņØśņŗĀļ│┤: ļīĆĒĢ£ņ╣śĻ│╝ņØśņé¼ĒśæĒÜī; 2023.
22. Crystal YO, Marghalani AA, Ureles SD, Wright JT, Sulyanto R, Divaris K et al. Use of silver diamine fluoride for dental caries management in children and adolescents, including those with special health care needs. Pediatr Dent 2017;39(5):135ŌĆō145.


23. Marinho VC, Worthington HV, Walsh T, Clarkson JE. Fluoride varnishes for preventing dental caries in children and adolescents. Cochrane Database Syst Rev 2013;2013(7):CD002279. https://doi.org/10.1002/14651858.CD002279.pub2.



24. Lansdown AB. Silver in health care: Antimicrobial effects and safety in use. Curr Probl Dermatol 2006;33:17ŌĆō34. https://doi.org/10.1159/000093928.


25. Peng JJ, Botelho MG, Matinlinna JP. Silver compounds used in dentistry for caries management: A review. J Dent 2012;40(7):531ŌĆō541. https://doi.org/10.1016/j.jdent.2012.03.009.


26. Liau SY, Read DC, Pugh WJ, Furr JR, Russell AD. Interaction of silver nitrate with readily identifiable groups: Relationship to the antibacterial action of silver ions. Lett Appl Microbiol 1997;25(4):279ŌĆō283. https://doi.org/10.1046/j.1472-765x.1997.00219.x.


27. Seifo N, Robertson M, MacLean J, Blain K, Grosse S, Milne R et al. The use of silver diamine fluoride (sdf) in dental practice. Br Dent J 2020;228(2):75ŌĆō81. https://doi.org/10.1038/s41415-020-1203-9.


28. Knight GM, McIntyre JM, Craig GG, Zilm PS, Gully NJ. Differences between normal and demineralized dentine pretreated with silver fluoride and potassium iodide after an in vitro challenge by streptococcus mutans. Aust Dent J 2007;52(1):16ŌĆō21. https://doi.org/10.1111/j.1834-7819.2007.tb00460.x.


29. Sorkhdini P, Crystal YO, Tang Q, Lippert F. The effect of silver diamine fluoride in preventing in vitro primary coronal caries under ph-cycling conditions. Arch Oral Biol 2021;121:104950. https://doi.org/10.1016/j.archoralbio.2020.104950.


30. Chu CH, Lo EC. Microhardness of dentine in primary teeth after topical fluoride applications. J Dent 2008;36(6):387ŌĆō391. https://doi.org/10.1016/j.jdent.2008.02.013.


31. Mei ML, Ito L, Cao Y, Li QL, Lo EC, Chu CH. Inhibitory effect of silver diamine fluoride on dentine demineralisation and collagen degradation. J Dent 2013;41(9):809ŌĆō817. https://doi.org/10.1016/j.jdent.2013.06.009.


32. Angker L, Swain MV, Kilpatrick N. Micro-mechanical characterisation of the properties of primary tooth dentine. J Dent 2003;31(4):261ŌĆō267. https://doi.org/10.1016/s0300-5712(03)00045-9.


33. Kinney JH, Marshall SJ, Marshall GW. The mechanical properties of human dentin: A critical review and re-evaluation of the dental literature. Crit Rev Oral Biol Med 2003;14(1):13ŌĆō29. https://doi.org/10.1177/154411130301400103.


34. Featherstone JD. The continuum of dental caries--evidence for a dynamic disease process. J Dent Res 2004;83 Spec No C:C39ŌĆō42. https://doi.org/10.1177/154405910408301s08.


35. Yu OY, Zhao IS, Mei ML, Lo ECM, Chu CH. Caries-arresting effects of silver diamine fluoride and sodium fluoride on dentine caries lesions. J Dent 2018;78:65ŌĆō71. https://doi.org/10.1016/j.jdent.2018.08.007.


36. Morresi AL, D'Amario M, Capogreco M, Gatto R, Marzo G, D'Arcangelo C et al. Thermal cycling for restorative materials: Does a standardized protocol exist in laboratory testing? A literature review. J Mech Behav Biomed Mater 2014;29:295ŌĆō308. https://doi.org/10.1016/j.jmbbm.2013.09.013.


37. Gale MS, Darvell BW. Thermal cycling procedures for laboratory testing of dental restorations. J Dent 1999;27(2):89ŌĆō99. https://doi.org/10.1016/s0300-5712(98)00037-2.


38. De Munck J, Van Landuyt K, Peumans M, Poitevin A, Lambrechts P, Braem M et al. A critical review of the durability of adhesion to tooth tissue: Methods and results. J Dent Res 2005;84(2):118ŌĆō132. https://doi.org/10.1177/154405910508400204.


39. Yoshida Y, Van Meerbeek B, Nakayama Y, Snauwaert J, Hellemans L, Lambrechts P et al. Evidence of chemical bonding at biomaterial-hard tissue interfaces. J Dent Res 2000;79(2):709ŌĆō714. https://doi.org/10.1177/00220345000790020301.


40. Zuellig-Singer R, Krejci I, Lutz F. Effects of cement-curing modes on dentin bonding of inlays. J Dent Res 1992;71(11):1842ŌĆō1846. https://doi.org/10.1177/0022034592071011150 1.


41. Ngo HC, Mount G, Mc Intyre J, Tuisuva J, Von Doussa RJ. Chemical exchange between glass-ionomer restorations and residual carious dentine in permanent molars: An in vivo study. J Dent 2006;34(8):608ŌĆō613. https://doi.org/10.1016/j.jdent.2005.12.012.


42. Tanumiharja M, Burrow MF, Tyas MJ. Microtensile bond strengths of glass ionomer (polyalkenoate) cements to dentine using four conditioners. J Dent 2000;28(5):361ŌĆō366. https://doi.org/10.1016/s0300-5712(00)00009-9.


43. Pereira PN, Yamada T, Tei R, Tagami J. Bond strength and interface micromorphology of an improved resin-modified glass ionomer cement. Am J Dent 1997;10(3):128ŌĆō132.

44. Cardoso MV, de Almeida Neves A, Mine A, Coutinho E, Van Landuyt K, De Munck J et al. Current aspects on bonding effectiveness and stability in adhesive dentistry. Aust Dent J 2011;56 Suppl 1:31ŌĆō44. https://doi.org/10.1111/j.1834-7819.2011.01294.x.


45. Almuammar MF, Schulman A, Salama FS. Shear bond strength of six restorative materials. J Clin Pediatr Dent 2001;25(3):221ŌĆō225. https://doi.org/10.17796/jcpd.25.3.r8g48vn51l46421m.


46. Sidhu SK, Nicholson JW. A review of glass-ionomer cements for clinical dentistry. J Funct Biomater 2016;7(3):https://doi.org/10.3390/jfb7030016.

47. Ng E, Saini S, Schulze KA, Horst J, Le T, Habelitz S. Shear bond strength of glass ionomer cement to silver diamine fluoridetreated artificial dentinal caries. Pediatr Dent 2020;42(3):221ŌĆō225.


48. Zhao IS, Chu S, Yu OY, Mei ML, Chu CH, Lo ECM. Effect of silver diamine fluoride and potassium iodide on shear bond strength of glass ionomer cements to caries-affected dentine. Int Dent J 2019;69(5):341ŌĆō347. https://doi.org/10.1111/idj.12478.


49. Mei ML, Ito L, Cao Y, Lo EC, Li QL, Chu CH. An ex vivo study of arrested primary teeth caries with silver diamine fluoride therapy. J Dent 2014;42(4):395ŌĆō402. https://doi.org/10.1016/j.jdent.2013.12.007.


50. Mei ML, Ito L, Cao Y, Li QL, Chu CH, Lo EC. The inhibitory effects of silver diamine fluorides on cysteine cathepsins. J Dent 2014;42(3):329ŌĆō335. https://doi.org/10.1016/j.jdent.2013.11.018.


51. Hiraishi N, Sayed M, Takahashi M, Nikaido T, Tagami J. Clinical and primary evidence of silver diamine fluoride on root caries management. Jpn Dent Sci Rev 2022;58:1ŌĆō8. https://doi.org/10.1016/j.jdsr.2021.11.002.


52. Garg S, Sadr A, Chan D. Potassium iodide reversal of silver diamine fluoride staining: A case report. Oper Dent 2019;44(3):221ŌĆō226. https://doi.org/10.2341/17-266-S.


-
METRICS

-
- 1 Crossref
- 0 Scopus
- 577 View
- 19 Download
- ORCID iDs
-
Dasol Yun

https://orcid.org/0009-0002-2789-0587Man-Hwan Oh

https://orcid.org/0000-0003-1045-5343Hojin Moon

https://orcid.org/0000-0003-3630-4658 - Related articles



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print