| J Korean Dent Assoc > Volume 62(4); 2024 > Article |
|
Abstract
Autogenous bone grafts remain the standard for cleft alveolus surgery despite absorption tendencies and donor site complications. DDM, derived from teeth, demonstrates promising osteoinductive properties comparable to autogenous bone. This paper aims to introduce and discuss cases of bone graft for cleft alveolus utilizing demineralized dentin matrix (DDM) derived from teeth, highlighting the outcomes and potential advantages of DDM in cleft alveolus reconstruction. A nine-year-old patient underwent cleft alveolus surgery with bilateral bone grafting. To address volume limitation of DDM, the surgical procedure involved harvesting bone from the anterior iliac crest. Postoperative radiographic assessments at nine months revealed favorable bone integration in the cleft region. The study advocates for further exploration of DDM applications in clinical recommends.
ýØ╝ý░¿ ÛÁ¼Û░£ýù┤(primary palate cleft)Ùèö ý×àýêáÛ│╝ ý╣ÿýí░ÙÅîÛ©░ýØÿ Û▓░ýåÉýØ┤ ÙÅÖÙ░ÿÙÉÿÙèö Û▓¢ýÜ░Û░Ç ýóàýóà ý×êÙïñ. ý╣ÿýí░ýù┤ýØ┤ ýÖäýáäÝòÿÛ▓î Ù░£ýâØÝò£ Û▓¢ýÜ░ýùÉÙèö ý£äÙí£Ùèö Ù╣äÛ░ò, ÝøäÙ░®ý£╝Ùí£Ùèö ÛÁ¼Û░£ ýáäÙ░®ÙÂÇýùÉ ýØ┤ýû┤ýºÇÙèö Û│¿ Û▓░ýåÉÙÂÇÛ░Ç Ù░£ýâØÝò£Ùïñ. ý╣ÿýòä Ùº╣ý£ ýºÇýù░Û│╝ Ýò¿Û╗ÿ, 5~30%ýØÿ ý£áý╣ÿýù┤ Û│╝ý×ëý╣ÿýÖÇ 10~40%ýØÿ ý©íýáêý╣ÿ Û▓░ýåÉýØ┤ Ù░£ýâØÝòá ýêÿ ý×êÙïñ[1]. ý╣ÿýí░ýù┤ ý×¼Û▒┤ýØä ý£äÝò£ ýêÿýêá ýï£Û©░ýùÉ ÙîÇÝò┤ýä£Ùèö Ùà╝Ù×ÇýØ┤ ý×êýºÇÙºî, ýâüýòàýØÿ ýä▒ý×ÑÛ│╝ ý╣ÿýòä Ùº╣ý£ýØä Û│áÙáñÝòá Ùòî Ýÿ╝Ýò®ý╣ÿýù┤Û©░(mixed denti┬¡tion)ýØÿ ýï£Û©░ ýñæ Û▓¼ý╣ÿýØÿ ý╣ÿÛÀ╝ýØ┤ 1/2ýùÉýä£ 2/3ýáòÙÅä Ýÿòýä▒ÙÉÿÙèö 9~11ýä©ÙÑ╝ Û░Çý×Ñ ýäáÝÿ©Ýò£Ùïñ. ýØ┤ ýï£Û©░ýùÉÙèö ýâüýòàÛ│¿ýØÿ ýä▒ý×ÑýØ┤ ýêÿýºüÙ░®ÝûÑýØä ýá£ýÖ©ÝòÿÙ®┤ Û▒░ýØÿ ýÖäÙúîÙÉÿýû┤ ýñæýòêÙ®┤ÙÂÇ ýä▒ý×ÑýùÉ ÙîÇÝò£ ýÿüÝûÑýØä ýÁ£ýåîÝÖöÝòá ýêÿ ý×êÛ│á Û▓¼ý╣ÿýØÿ Ùº╣ý£Û▓¢Ùí£ ýâüýØÿ ý╣ÿýí░Û│¿ýØä Ýÿòýä▒Ýòÿýù¼ ÛÁÉýáòýáüý£╝Ùí£ÙÅä ýâüÙï╣Ýò£ ýØ┤ýáÉýØä ýû╗ýØä ýêÿ ý×êÙïñ[1].
ý╣ÿýí░ýù┤ Û│¿ýØ┤ýïØýêáýØ┤ ýä▒Û│ÁÝòÿÛ©░ ý£äÝò┤ýä£Ùèö ÙïñýØîÛ│╝ Û░ÖýØÇ ýä©Û░ÇýºÇ ýøÉý╣ÖýØ┤ Û░òýí░ÙÉ£Ùïñ. 1) Ù╣äÛ░òýáÇ(nasal floor) ý×¼Û▒┤Û│╝ Ù╣äÛ░òý©í ÝÅÉýçä, 2) ý®ÙÂäÝò£ ýûæýØÿ ýØ┤ýïØÛ│¿Ùí£ Û│¿Û▓░ýåÉÙÂÇ ý®ýáä, 3) ý╣ÿýØÇ ýáÉÙºëÛ│¿ÙºëÝö╝ÝîÉ(gingival mucoperiosteal flap)ý£╝Ùí£ ÛÁ¼Û░òý©í ÝÅÉýçä. ýáäÝåÁýáüý£╝Ùí£ ý╣ÿýí░ýù┤ýØä ý£äÝò£ Û│¿ýØ┤ýïØýêáýØÇ ý×ÉÛ░ÇÛ│¿ýØ┤ Ýæ£ýñÇý£╝Ùí£ ýòîÙáñýá© ý×êÙïñ. ý×ÉÛ░ÇÛ│¿ýØÇ ÙæÉÛ░£Û│¿(cranial bone)ýØ┤Ùéÿ ÝòÿýòàÛ│¿(mandible)ÙÅä Û│Áýù¼ÙÂÇÙí£ ýóàýóà ýäáÝâØÙÉÿýºÇÙºî, ý▒äýÀ¿Û░Ç ýÜ®ýØ┤ÝòÿÛ│á, ÙºÄýØÇ ýûæýØä ý▒äýÀ¿Ýòá ýêÿ ý×êÛ│á, ý╣ÿýí░ýù┤ÙÂÇý£äÙÑ╝ ýêÿýêáÝòÿÙ®┤ýä£ ÙÅÖýï£ýùÉ ýØ┤ýïØÛ│¿ýØä ý▒äýÀ¿Ýòá ýêÿ ý×êÙèö ý×ÑÛ│¿ÙèÑ(iliac crest)ýØ┤ Û░Çý×Ñ ÙºÄýØ┤ ýé¼ýÜ®ÙÉÿÛ│á ý×êÙïñ[2]. ÛÀ©ÙáçýºÇÙºî ý×ÑÛ│¿ýØÇ Ù│┤Ýûë ý×ÑýòáÙÑ╝ ý┤êÙ×ÿÝòá Û░ÇÙèÑýä▒ýØ┤ ý×êÛ│á, ÝØíýêÿÙÉÿÙèö Û▓¢ÝûÑýØ┤ ÙºÄýØÇ ýáÉýØ┤ Ùï¿ýáÉýØ┤Ùïñ. ýØ┤ÙÑ╝ ÛÀ╣Ù│ÁÝòÿÛ©░ ý£äÝò┤ ý×¼ýâØýØÿÝòÖÙÂäýò╝ýùÉýä£ ýïáÙó░Ýòá ýêÿ ý×êÙèö ÙîÇýòêýØä ýá£Û│ÁÝòÿÛ©░ ý£äÝò┤ ÙºÄýØÇ Ùà©ÙáÑýØä Û©░ýÜ©ýØ┤Û│á ý×êÙïñ. 2020Ùàä Osorio Ùô▒ýØÇ ý▓┤Û│äýáü Û│áý░░ýØä ÝåÁÝò┤ ý×ÉÛ░ÇÛ│¿Û│╝ Ýò¿Û╗ÿ platelet-rich plasma(PRP), hydroxyapatite(HA), deproteinized bovine bone(DBB), fibrin glue Ùô▒ýØä ýé¼ýÜ®ÝûêýØä Ùòî, ý▒äýÀ¿Ýòá ý×ÉÛ░ÇÛ│¿ýØÿ ÙÂÇÝö╝ÙÑ╝ ýñäýØ╝ ýêÿ ý×êÛ│á Ù╝êÝØíýêÿ ýåìÙÅäÙÑ╝ Û░Éýåîýï£Ýé¼ ýêÿ ý×êý£╝Ù®░, BMPÙÑ╝ Ýò¿Û╗ÿ ýé¼ýÜ®ÝûêýØä Ùòî Ùìö Ùºîýí▒ýèñÙƒ¼ýÜ┤ Ù╝êý╣ÿý£áÙÑ╝ ýá£Û│ÁÝòá ýêÿ ý×êÙïñÛ│á ýû©Û©ëÝûêÙïñ[3]. 2022Ùàä Alkaabi Ùô▒ýØÇ Ù®öÝâÇ ÙÂäýäØýØä ÝåÁÝò┤ ÙïñýûæÝò£ ý×¼ýâØýí░ýºüÛ│ÁÝòÖýáü Ù░®Ù▓ò(Û│¿ýêÿÙï¿ÝòÁýä©Ýż(BMC), ýñäÛ©░ýä©Ýż(lxmyelocel-T), plate-rich fibrin(PRF), Ýÿæý©í ýºÇÙ░®Ýî¿Ùô£ ý£áÙ×ÿ ýñæÛ░äýù¢ ýñäÛ©░ýä©Ýż(BFSC), ÙåìýÂò ýä▒ý×ÑýØ©ý×É(CGF), Ýÿêý×Ñ ÝÆìÙÂÇ ýä▒ý×Ñ ýØ©ý×É(PRGF), rhBMP-2ÙÑ╝ ýáüýÜ®Ýò£ Û▓¢ýÜ░ ý×ÉÛ░ÇÛ│¿ýØ┤ýïØýêáÙºî Ýò£ Û▓¢ýÜ░ýùÉ Ù╣äÝò┤ ýâêÙí£ýÜ┤ Ù╝ê Ýÿòýä▒ýØ┤ ý£áÙª¼Ýò£ Û▓░Û│╝ÙÑ╝ Ù│┤Û│áÝòÿýÿÇÙïñ[4]. ÛÀ©Ùƒ¼Ùéÿ ÛÀ© ý░¿ýØ┤Û░Ç ÝåÁÛ│äýáüý£╝Ùí£ ý£áýØÿÙ»©Ýò£ ý░¿ýØ┤Û░Ç ýùåýùêÛ│á, ýØ┤ýºêýä▒ýØ┤ ÙåÆÛ│á, ý╣ÿýòä Ùº╣ý£ýØä Û│áÙáñÝò£ Û▓░Û│╝Ùèö Û▒░ýØÿ ýùåýùêÛ©░ ÙòîÙ¼©ýùÉ Ùìö ÝÜ¿Û│╝ýáüýØ© Û│¿ýØ┤ýïØÛ▓░Û│╝ÙÑ╝ ý£äÝò£ ýí░ýºüÛ│ÁÝòÖýáü Û░£ýäáýØ┤ ÝòäýÜöÝòÿÙïñÛ│á ÝûêÙïñ.
Û┤æÙ¼╝ÝÖöÙÉ£ ýí░ýºüý£╝Ùí£ýä£ Ù╝êýÖÇ ýâüýòäýºêýØÇ ý£áýé¼Ýò£ ÛÁ¼ýä▒ýØä Û░ÇýºÇÙ®░, ýâüýòäýºêýØÿ Û│¿ý£áÙÅäÙèÑýØÇ 1967ÙàäÙÂÇÝä░ ý×àýñæÙÉÿýû┤ ýÖöÙïñ[5]. HAÙÑ╝ ýØ╝ÙÂÇ ýá£Û▒░Ýò£ ÝâêÝÜî ýâüýòäýºê Û©░ýºê(demin┬¡eralized dentin matrix, DDM)ýØÇ ÝâêÝÜîÝòÿýºÇ ýòèýØÇ ýâüýòäýºê(fresh dentin)ýùÉ Ù╣äÝò┤ Û│¿ý£áÙÅäÙèÑýØ┤ Ùìö Û░òýí░ÙÉ£Ùïñ. 2013Ùàä Hara Ùô▒ýØÇ ÝÖÿýòäýØÿ Û│╝ý×ëý╣ÿÙí£ ÙºîÙôá DDMýØä ýØ┤ýÜ®Ýò£ ý╣ÿýí░ýù┤ Û│¿ýØ┤ýïØýêáýØä ýï£ÝûëÝòÿýÿÇÛ│á[6], 2022Ùàä Mat┬¡suzawaÙô▒ýØÇ ÝÖÿýòäýØÿ ý£áý╣ÿÙí£ ÙºîÙôá DDMýØä ýØ┤ýÜ®Ýò£ ý╣ÿýí░ýù┤ Û│¿ýØ┤ýïØýêáýØä Ù│┤Û│áÝòÿýÿÇÙïñ[7]. ý╣ÿýòäý£áÙ×ÿÛ│¿ýØä ýØ┤ýÜ®Ýò£ Û│¿ýØ┤ýïØýêá ÙÂÇý£äýØÿ DDM ý×àý×ÉÙèö ý╣ÿýòä Ýÿòýä▒ýØä Ù░®Ýò┤ÝòÿÛ▒░Ùéÿ ý×ÉÙ░£ýáüýØ© ý╣ÿýòä Ùº╣ý£ýØä ýûÁýá£ÝòÿýºÇ ýòèÛ│á Ýÿ©ýèñÝè© ýí░ýºüÛ│╝ ýí░ÝÖöÙÑ╝ ýØ┤Ùú¿Û│á Ù╝êÙí£ ÙîÇý▓┤ÙÉÿýû┤ ý×ÉÛ░ÇÛ│¿ýØÿ ÙîÇýòêýØ┤ ÙÉá ýêÿ ý×êýØîýØä Ù│┤ýù¼ýú╝ýùêÙïñ.
ÛÁ¡Ùé┤ýùÉýä£Ùèö 1993ÙàäÙÂÇÝä░ ÛÁ¼Û░òýòàýòêÙ®┤ýÖ©Û│╝ Û╣ÇýÿüÛÀá ÛÁÉýêÿýÖÇ ýùäýØ©ýøà Ù░òýé¼Û░Ç ý╣ÿýòäý£áÙ×ÿÛ│¿ýØ┤ýïØý×¼ Û░£Ù░£ýØä ýï£ý×æÝòÿýù¼, 2008Ùàä Ýò£ÛÁ¡ý╣ÿýòäýØÇÝûëýùÉýä£ ý╣ÿýòäý£áÙ×ÿÛ│¿ýØÿ ý▓ÿÙª¼Û│ÁýáòýØä Ýæ£ýñÇÝÖöÝòÿýù¼ ýä©Û│äýÁ£ý┤êÙí£ ýâüÝÆêÝÖöÝòÿýù¼ ýé¼ýÜ®ÙÉÿÛ│á ý×êÙïñ[8]. 2015ÙàäýùÉÙèö ý╣ÿýú╝ýºêÝÖÿ ý▓ÿý╣ÿÙí£ ý╣ÿýí░Û│¿Û▓░ýåÉÙÂÇ Û│¿ýØ┤ýïØýêáýùÉ ýïáýØÿÙúîÛ©░ýêáÙí£ ýØ©ýáòÙ░øýòÿÛ│á, 2021Ùàä ýòàÛ│¿ Û▓░ýåÉÙÂÇ ÙÿÉÙèö Ýç┤ýÂòÙÂÇýùÉ ý×ÉÛ░Çý╣ÿýòäý£áÙ×ÿÛ│¿ýØ┤ýïØýêáýØ┤ ýïáýØÿÙúîÛ©░ýêáÙí£ ýØ©ýáòÙ░øýòÿÙïñ. Ù│© Ùà╝Ù¼©ýØÿ Ù¬®ýáüýØÇ ý×ÉÛ░ÇÛ│¿Û│╝ Ýò¿Û╗ÿ ý╣ÿýòäý£áÙ×ÿÛ│¿ýØä ÝÖ£ýÜ®Ýò£ ý╣ÿýí░ýù┤ ýêÿýêá ýªØÙíÇÙÑ╝ ýåîÛ░£ÝòÿÛ│á, ý╣ÿýí░ýù┤ ýêÿýêáýùÉýä£ ý╣ÿýòäý£áÙ×ÿÛ│¿ýØÿ ÝÖ£ýÜ®ýùÉ ÙîÇÝòÿýù¼ Ùà╝Ýò┤Ù│┤Û│áý×É Ýò£Ùïñ.
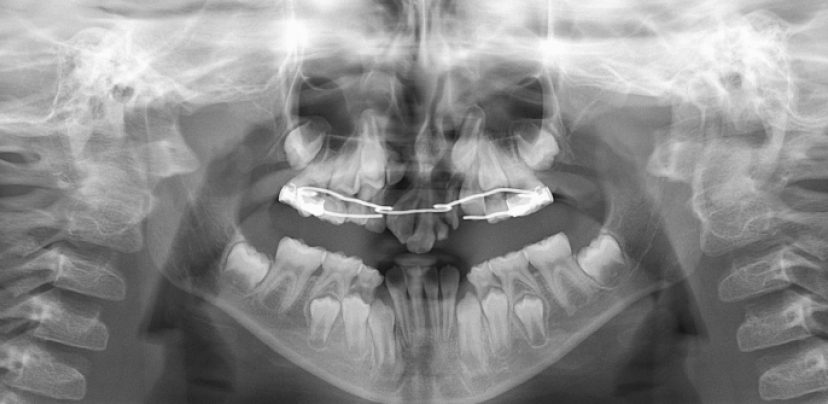
Ùºî 9ýä© Ùé¿ÝÖÿýØ┤ ý╣ÿýí░ýù┤ ýêÿýêáýØä Ù░øÛ©░ ý£äÝò┤ ýáäÙÂüÙîÇÝòÖÛÁÉ ý╣ÿÛ│╝Ù│æýøÉ ÛÁ¼Û░òýòàýòêÙ®┤ýÖ©Û│╝ýùÉ Ùé┤ýøÉÝòÿýÿÇÙïñ(Fig. 1).
ÛÁ¼Û░òýòàýòêÙ®┤ýÖ©Û│╝ýùÉýä£Ùèö 2013Ùàä 10ýøö ýûæý©íýä▒ ÛÁ¼ýê£ÛÁ¼Û░£ýù┤Ùí£ ýêÿýêáÙ░øýòÿÛ│á, 2023Ùàä 10ýøö ÛÁ¼Û░£ýù┤Û│╝ ý¢ö Ù│ÇÝÿòýùÉ ÙîÇÝò£ ýêÿýêáÙ░øýØÇ Ù│æÙáÑýØ┤ ý×êýùêÛ│á, ý╣ÿýí░ýù┤ ýêÿýêá ýáä ÛÁ¼Û░£ý©í ÙÂÇý£äýØÿ Û│╝ý×ëý╣ÿ 2Û░£ Ù░£ý╣ÿÝòÿýÿÇÙïñ. ýáäýïáÙºêýÀ¿ Ýòÿ ý╣ÿýí░ýù┤ Û│¿ýØ┤ýïØýêáýØä Û│äÝÜìÝòÿýÿÇÙïñ. ýØ┤ ÝÖÿý×ÉýùÉÛ▓îÙèö rhBMP-2Û░Ç ý¢öÝîàÙÉ£ ý╣ÿýòäý£áÙ×ÿÛ│¿(BTS, Ýò£ÛÁ¡ý╣ÿýòäýØÇÝûë, ýä£ýÜ©, Ýò£ÛÁ¡)ýØä ýñÇÙ╣äÝòÿýÿÇÙïñ. Û▓░ýåÉÙÂÇýØÿ ÝÿòÝâ£ýÖÇ Ýü¼Û©░ÙÑ╝ Û│áÙáñÝòá Ùòî ýáäÙ░®ý×ÑÛ│¿ÙèÑýùÉýä£ Ù©öÙØ¢Û│¿ý▒äýÀ¿ÙÑ╝ ÝòÿÛ│á, ý╣ÿýòäý£áÙ×ÿÛ│¿Û│╝ Ýÿ╝Ýò®Ýòÿýù¼ Û│¿ýØ┤ýïØýêáýØä Û│äÝÜìÝòÿýÿÇÙïñ(Fig. 2).
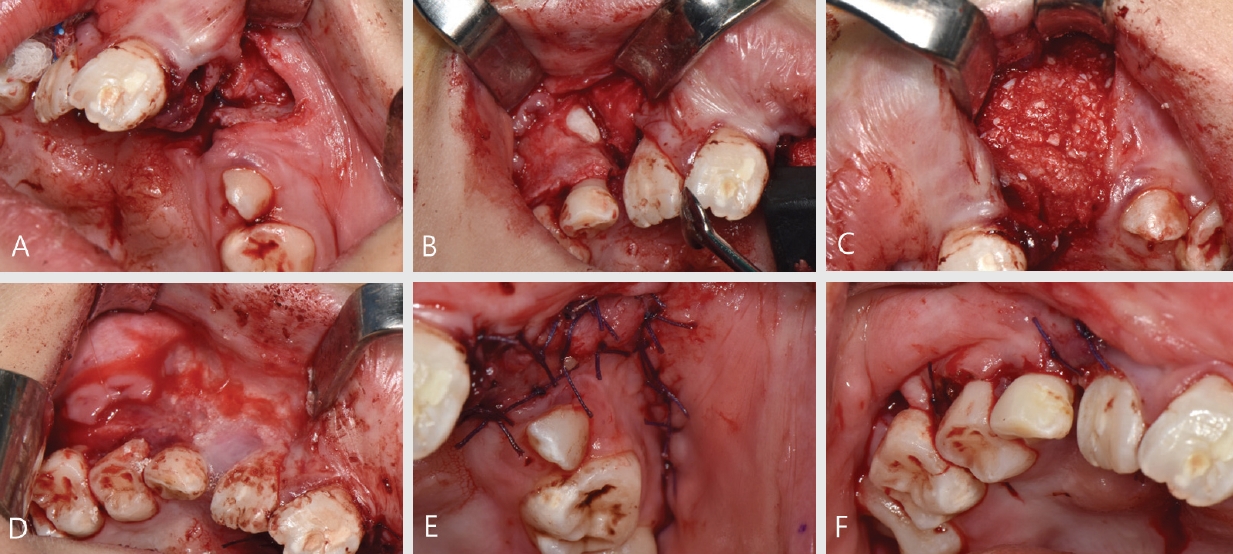
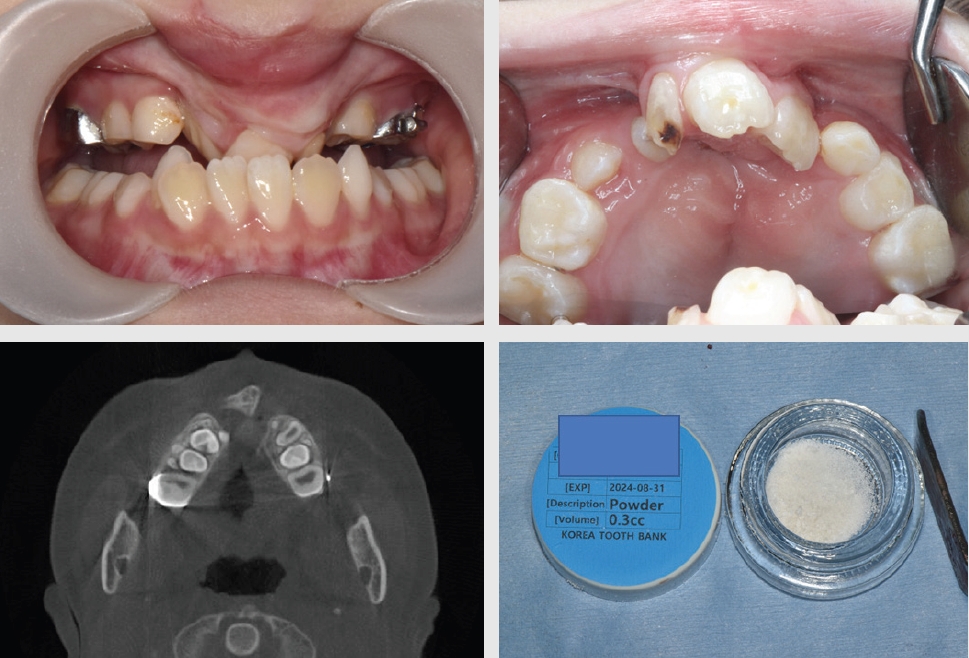
ÝÖÿý×ÉÙèö ýáäýïáÙºêýÀ¿ ÝòÿýùÉ ýòÖýÖÇý£ä(supine position)Ùí£ ý£äý╣ÿýï£ÝéñÛ│á, ÛÁ¼Û░òÛ│╝ ýóîý©í ý×ÑÛ│¿ÙÂÇý£äÙÑ╝ ÝżÙ╣äÙÅêýØä ýØ┤ýÜ®Ýòÿýù¼ ýåîÙÅàÝòÿýÿÇÙïñ. ýêÿýêá ÙÂÇý£äýùÉ 1:100,000 ýùÉÝö╝ÙäñÝöäÙª░ Ýò¿ý£áÙÉ£ Ùª¼ÙÅäý╣┤ýØ©ý£╝Ùí£ ý╣¿ý£ñÙºêýÀ¿ÙÑ╝ ÝòÿýÿÇÙïñ. Ù¿╝ýáÇ ýóîý©í ýáäÙ░® ý×ÑÛ│¿ÙèÑ(anterior iliac crest)ýÖÇ ýáäýâüý×ÑÛ│¿ÙÅîÛ©░(anterior superior iliac spine, ASIS)ÙÑ╝ ÙÅäÝò┤ÝûêÙïñ(Fig. 3A) . ý×ÑÛ│¿ÙèÑýØÿ ýÖ©ý©íý£╝Ùí£ 1cm Û░ÇÙƒë Ùû¿ýû┤ýºä Û││ýùÉýä£ ýáêÛ░£ýäáýØä Ýÿòýä▒ÝòÿýÿÇÛ│á, ÙîÇÝç┤ÛÀ╝Ùºëý×ÑÛÀ╝(tensor fascia latae)ýØÿ ýåÉýâüýØä ýÁ£ýåîÝÖöÝòÿÛ©░ý£äÝò┤ Ùé┤ý©í ýáæÛÀ╝Ù▓òý£╝Ùí£ ýºÇÙ░®ý©ÁÛ│╝ ÛÀ╝ý£í, Û│¿ÙºëýØä Ù░òÙª¼Ýòÿýù¼ ý×ÑÛ│¿ÙèÑýùÉ ýáæÛÀ╝Ýòÿýù¼ ÙºØýâüÛ│¿Û│╝ Ýö╝ýºêÛ│¿ýØä ý▒äýÀ¿ÝòÿýÿÇÙïñ(Fig, 3B, C). Û│¿ýØä ý▒äýÀ¿Ýò£ Ýøä ýáêÛ░£Ýò£ ýù░Û│¿ýØÇ 2-0 nylonýØ┤ýÜ®Ýòÿýù¼ Û│áýáòýï£ý╝░Û│á, ýé¼Û░ò(dead space)ÙÑ╝ Ù░®ýºÇÝòÿÛ©░ ý£äÝò┤ Ù░░ýòíÛ┤ÇýØä ýé¢ý×àÝòÿÛ│á ý©ÁÙ│äÙ┤ëÝò®ýØä ýï£ÝûëÝòÿýÿÇÙïñ(Fig. 3D).
ÛÁ¼Û░ò Ùé┤ ýáäýáòÙÂÇýùÉÙÅä ÙÅÖýØ╝ÝòÿÛ▓î ý╣¿ý£ñÙºêýÀ¿ÙÑ╝ ýï£ÝûëÝòÿÛ│á, ýâüýòà ýáäý╣ÿÙÂÇýùÉ crestal incisionýØä Ýÿòýä▒Ýòÿýù¼ mu┬¡coperiosteal flapýØä Û▒░ýâüÝòÿÙ®┤ýä£ ý╣ÿýí░ýù┤ ÙÂÇý£ä bone marginýØ┤ Ùà©ý£ÙÉá ÙòîÛ╣îýºÇ Ù░òÙª¼ÝòÿýÿÇÛ│á, ÙÂêÝòäýÜöÝò£ ýù░ýí░ýºüýØä ýáêýá£ÝûêÙïñ. ýØ┤Ùòî, ÛÁ¼Û░£ý©íÛ│╝ Ù╣äÛ░òý©í ýù░ýí░ýºüýØÇ ýÁ£ÙîÇÝò£ Ù│┤ýí┤ÝòÿýÿÇÛ│á, 4-0 vicrylýØä ýØ┤ýÜ®Ýòÿýù¼ Ù┤ëÝò®Ýòÿýù¼ Û│¿ýØ┤ýïØýêáýØä ý£äÝò£ ýêÿýÜ®ÙÂÇ preparationýØä ýï£ÝûëÝòÿýÿÇÙïñ(Fig. 4A, B). ý▒äýÀ¿Ýò£ ý×ÑÛ│¿ýùÉýä£ ýáüýáêÝò£ Ýü¼Û©░ýØÿ Ù©öÙíØÙ│© 2Û░£ÙÑ╝ Û░üÛ░ü ýûæý©í Ù╣äÛ░òýáÇýùÉ ý£äý╣ÿýï£ý╝░Û│á, ÙéÿÙ¿©ýºÇ Û│¿ýØÇ Bone crusherÙí£ ÙÂäýçäÝòÿýù¼ DDMÛ│╝ Ýÿ╝Ýò®Ýòÿýù¼ Û▓░ýåÉÙÂÇýùÉ ý®ýáäÝòÿýÿÇÙïñ(Fig. 4C). Fibrin sealant(Tisseel, Baxter, USA)ýØä ýØ┤ýÜ®Ýòÿýù¼ ýØ┤ýïØý×¼ýØÿ ý£áÙÅÖýä▒ýØä ýÁ£ýåîÝÖöÝòÿÛ│á ýºÇÝÿêý▓ÿý╣ÿÙÑ╝ ýï£ÝûëÝòÿÛ│á(Fig. 4D), Ýÿòýä▒Ýò£ flapýØä advanceýï£ý╝£ ýØ╝ý░¿ Ù┤ëÝò®ýØä Ùï¼ýä▒ÝòÿýÿÇÙïñ(Fig. 4E, F).
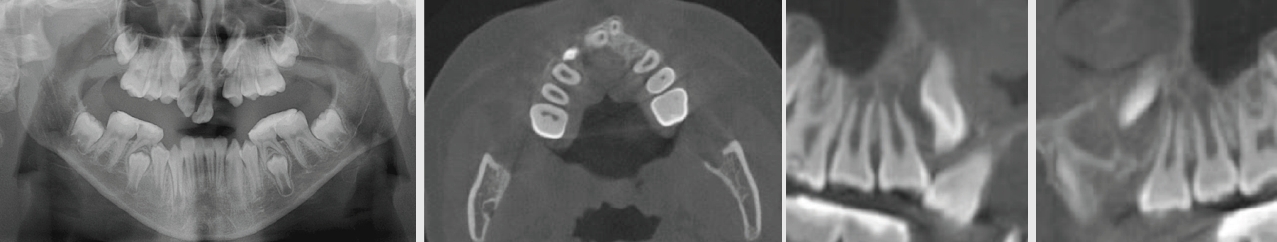
ÝÖÿý×ÉýØÿ ýâüýòà ýñæýáêý╣ÿýØÿ ýï¼Ýò£ ÛÁ¼Û░£ý©í Û▓¢ýé¼Ùí£ ýÖ©ýâüýä▒ ÛÁÉÝò®ýØ┤ ÝÖòýØ©ÙÉÿýû┤ ÛÁ¼ý╣ÿÙÂÇýùÉ ÙáêýºäýØä ýÂöÛ░ÇÝòÿýù¼ ÛÁÉÝò®ÙáÑýØ┤ premaxillaÙí£ Û░ÇÝò┤ýºÇÙèö Û▓âýØä ýÁ£ýåîÝÖöÝòÿýÿÇÙïñ. ýêÿýêá Ýøä 1ýú╝ýØ╝ Ýò¡ýâØýᣠÙ░Å ýåîýù╝ýºäÝåÁýᣠý▓ÿÙ░®ÝòÿýÿÇÛ│á, ýêÿýêá Ýøä Ù│┤Ýûëý×ÑýòáÙèö ýùåýùêýºÇÙºî ýóîý©í ý×ÑÛ│¿ ÙÂÇý£äýØÿ ÝåÁýªØýØä 1Û░£ýøö ýáòÙÅä Ýÿ©ýåîÝòÿýÿÇÙïñ. 2Û░£ýøö Ýøä premaxillaýØÿ ÙÅÖýÜöÙÅäÛ░Ç ýåîýïñÙÉ£ Û▓âýØä ÝÖòýØ©ÙÉÿýùêÙïñ. ýêÿýêá 9Û░£ýøö Ýøä ý┤¼ýÿüÝò£ Ù░®ýé¼ýäá ýé¼ýºä ýâü ýûæÝÿ©Ýò£ Û│¿ý╣ÿý£á ýûæýâüýØ┤ ÝÖòýØ©ÙÉ£Ùïñ(Fig. 5).
Û│Áýù¼ ÙÂÇý£ä ýØ┤ÝÖÿý£¿Û│╝ ÝØíýêÿ Û▓¢ÝûÑýùÉÙÅä ÙÂêÛÁ¼ÝòÿÛ│á ý×ÉÛ░ÇÛ│¿ýØÇ Û│¿ýáäÙÅä, Û│¿ý£áÙÅä Ù░Å Û│¿Ýÿòýä▒ Ýè╣ýä▒ýùÉ ý×êýû┤ Û│¿ ýØ┤ýïØ ýêÿýêáýØÿ Ýæ£ýñÇýØ┤Ùïñ. ÛÀ©ÙáçýºÇÙºî ý×ÑÛ│¿ÙèÑÛ│╝ Û░ÖýØÇ ýù░Û│¿Ùé┤Û│¿ÝÖöÙí£ Ýÿòýä▒ÙÉ£ Û│¿ýØÇ ÝòÿýòàÛ│¿Û│╝ Û░ÖýØÇ ÙºëÙé┤Û│¿ÝÖöÙí£ Ýÿòýä▒ÙÉ£ Û│¿ýùÉ Ù╣äÝò┤ 3~4Ù░░ Ùìö ÝØíýêÿÛ░Ç Ùìö ÙºÄÙïñÛ│á ýòîÙáñýá© ý×êÙïñ[9]. ýâüýòäýºêÛ│╝ Û│¿ýØÇ Ù¬¿ÙæÉ ý¢£ÙØ╝Û▓É(18%), Ù╣äý¢£ÙØ╝Û▓Éýä▒ Ùï¿Ù░▒ýºê(2%), ýêÿýé░ÝÖöýØ©ÝÜîýäØ(HAp)(70%) Ù░Å ý▓┤ýòí(10%)ý£╝Ùí£ ý£áýé¼Ýò£ ÛÁ¼ýä▒ý£╝Ùí£ ÛÁ¼ýä▒ÙÉÿÙ®░, ýâüýòäýºê Ùé┤ýØÿ Û│¿Ýÿòýä▒Ùï¿Ù░▒ýºê(BMP)ýØÇ Ù╝êýùÉýä£ ýÂöý£Ýò£ BMPýÖÇ ý£áýé¼Ýò£ Û│¿ý£áÙÅäýä▒ýØä Ù│┤ýù¼ýñÇÙïñ[10]. ý╣ÿýòä ý£áÙ×ÿ Ù╝ê Û©░ýºêýØ© DDMýØÇ Ýö╝ýºê-Ýò┤Ù®┤ Ù│ÁÝò®ý▓┤(cortico-cancellous bone)Ùí£ Ùª¼Ù¬¿Ùì©ÙºüÝòÿÙèö Û│¿ý╣ÿý£á ÙèÑÙáÑýØ┤ ý×ÉÛ░ÇÛ│¿Û│╝ ý£áýé¼ÝòÿÙïñÙèö ýá£ýï£ÙÉÿýùêÙïñ. Ýè╣Ý×ê, Û│¿ý£áÙÅäýä▒Û│╝ Û│¿ý╣ÿý£áÙèÑÙáÑýØ┤ ý×ÉÛ░ÇÛ│¿ýùÉ ÝòäýáüÝò£ Û▓âý£╝Ùí£ Ù│┤Û│áÙÉÿÙ®┤ýä£ ÙïñýûæÝò£ ÙÂäýò╝ýùÉ ÝÖ£ýÜ®ÙÉÿÛ│á ý×êÙïñ[11~14]. Ýè╣Ý×ê, 2023Ùàä ý×äÝöîÙ×ÇÝè©ÙÑ╝ ý£äÝò£ Û│¿ýØ┤ýïØ ýêÿýêáýØÿ Û▓░Û│╝ýùÉ ÙîÇÝò£ ý▓┤Û│äýáüÛ│áý░░ýùÉýä£ ý╣ÿýòäý£áÙ×ÿÛ│¿ýØÇ Bio-OssýÖÇ ý£áýé¼Ýò£ ýáòÙÅäÙí£ Ù│Çýù░Û│¿ýØÿ ÝØíýêÿÛ░Ç ýáüýùêÙïñ[13]. ý×ÉÛ░ÇÛ│¿Û│╝ ý╣ÿýòäý£áÙ×ÿÛ│¿ýØä Ýò®Û╗ÿ ýé¼ýÜ®Ýò£ Ù│© ýªØÙíÇýùÉýä£ ýûæý©í ý╣ÿýí░ýù┤ ÙÂÇý£äýùÉ Û│¿ Ù©îÙª┐ýºÇ (Bone Bridge)Û░Ç Ýÿòýä▒ÙÉÿýû┤ ýñæýáêý╣ÿÛ░Ç ý×êÙèö ýáäýâüýòàÛ│¿(premaxilla)ýØÿ ýòêýáòÝÖöýÖÇ Û▓¼ý╣ÿÛ░Ç Ùº╣ý£Ýòá ýêÿ ý×êÙèö ýù¼Û▒┤ýØä ÙºîÙôñ ýêÿ ý×êýùêÙïñ.
Ù░£ý╣ÿÝò£ ý╣ÿýòäÙí£ ýá£ý×æÝòÿÙèö ý×ÉÛ░Çý╣ÿýòäý£áÙ×ÿÛ│¿(Auto-DDM)ýØÇ ýØ┤ ÝÖÿý×ÉýØÿ Û▓¢ýÜ░ýÖÇ Û░ÖýØ┤ ÛÀ© ÙÂÇÝö╝Û░Ç Ýò£ýáòÙÉÿýû┤ ý×êÙèö Û▓âýØ┤ Ùï¿ýáÉýØ┤Ùïñ. ý×ÉÛ░ÇÛ│¿ýØä ÙîÇý▓┤ÝòÿÛ©░ ý£äÝò┤ ÙÅÖýóàÛ│¿(demineralized dentin matrix)ýØ┤ Û░£Ù░£ÙÉ£ Û▓â ý▓ÿÙƒ╝, ý×ÉÛ░Çý╣ÿýòäý£áÙ×ÿÛ│¿ýØä ÙîÇý▓┤ÝòÿÛ©░ ý£äÝò£ ÙÅÖýóà ý╣ÿýòäý£áÙ×ÿÛ│¿(allo┬¡geneic demineralized dentin matrix; Allo-DDM)ýùÉ ÙîÇÝò£ ýù░ÛÁ¼Û░Ç ýºäÝûëÙÉÿÛ│á ý×êÙïñ. ÙºÄýØÇ ýù░ÛÁ¼ÙôñýùÉ ýØÿÝò┤ýä£ Allo-DDMýØÿ Û│¿ý£áÙÅäÙèÑýØ┤ ý×àýªØÙÉÿýùêÛ│á, ý×äýâüýáüý£╝Ùí£ ýòêýáäÝòÿÛ▓î ýé¼ýÜ®Ýòá ýêÿ ý×êýØä ýáòÙÅäýØÿ Ýò¡ýøÉýä▒Û│╝ Ù®┤ýù¡ýøÉýä▒ýØä Ù│┤Û│áÝòÿÛ│á ý×êÙïñ[15,16]. Ýè╣Ý×ê, DDMýØÇ ýâüýòäýºêýØÿ ýâüýòäýä©Û┤Ç(dentinal tubule)Ùí£ ýØ©Ýò┤ micro-size porous ÛÁ¼ýí░ÙÑ╝ Û░ÇýºÇÛ│á ý×êýû┤ýä£, rhBMP-2ýÖÇ Û░ÖýØÇ ýä▒ý×ÑýØ©ý×ÉýØÿ carrierýØÿ ýù¡ÝòáÙí£ÙÅä ýú╝Ù¬®Ù░øÛ│á ý×êÙïñ[17,18]. 2022Ùàä rhBMP-2Ùí£ ý¢öÝîàÙÉ£ Allo-DDMÛ│╝ Auto-DDMýØÇ ýí░ýºüÝòÖýáü Ù░Å ýí░ýºüÝÿòÝâ£ÝòÖýáüý£╝Ùí£ ý£áýé¼Ýò£ ýáòÙÅäýØÿ Û│¿ý╣ÿý£áýûæýâüýØä Ù│┤ýÿÇÛ│á, ý×äÝöîÙ×ÇÝè©ýØÿ Û©░ÙèÑ 2Ùàä Ýøä Ù│Çýù░Û│¿ ÝØíýêÿÙèö ÝÅëÛÀá 0.2~0.3 mm ýáòÙÅäýØÿ ýòêýáòýáüýØ© Û▓░Û│╝ÙÑ╝ Ù│┤Û│áÝò£ Ù░ö ý×êÙïñ[19]. ý×ÉÛ░ÇÛ│¿, ý¢£ÙØ╝Û▓É ýèñÝÄÇýºÇ, ÙÅÖýóàÛ│¿, Ý×êýòîÙú¿Ùíáýé░ Û©░Ù░ÿ ÝòÿýØ┤Ùô£Ùí£Û▓öýØä ýºÇýºÇý▓┤Ùí£ rhBMP-2ÙÑ╝ ýé¼ýÜ®Ýòÿýù¼ ý╣ÿýí░ýù┤ýØÿ Û│¿Ýÿòýä▒ýØä ýù░ÛÁ¼Û░Ç ýï£ÙÅäÙÉÿÛ│á ý×êý£╝Ùéÿ ý×äýâüýáü ý£áÝÜ¿ýä▒ýØä Û▓ÇýªØÝòÿÛ©░ ý£äÝò£ Û▓░ÙíáýØä Ùé┤Û©░ýùÉÙèö ýòäýºü ÙÂÇýí▒ÝòÿÙïñ[20]. DDMýØÇ rhBMP-2ýùÉ ÙîÇÝò£ ýê£ý░¿ýáü ýáäÙï¼ ýºÇýºÇý▓┤Ùí£ýä£ ýá£ýû┤ÙÉ£ Ù░®ýïØý£╝Ùí£ ýé¼ýÜ®ÙÉá ýêÿ ý×êý£╝Ù®░, Ùö░ÙØ╝ýä£ ÛÁ¡ýåîÝÖöÙí£ ýØ©Ýò┤ ý×ÑÛ©░Û░ä rhBMP-2 ÙåìÙÅäÙÑ╝ ý£áýºÇ Û░ÇÙèÑÝòÿÛ©░ ÙòîÙ¼©ýùÉ, rh┬¡BMP-2 ÙåìÙÅäÙÑ╝ FDAýùÉýä£ ýè╣ýØ©ÙÉ£ 1.5mg/mLÙ│┤Ùïñ Ùìö Ùé«ýØÇ 0.2mg/mLýØÿ ÙåìÙÅäÙí£ÙÅä BMPýØÿ Û│¿ý£áÙÅäÙèÑ ÝÜ¿Û│╝ÙÑ╝ ý£áýºÇÝòá ýêÿ ý×êýØä Û▓âýØ┤ÙØ╝Û│á ýá£ýòêÙÉÿýùêÙïñ[18]. Ùö░ÙØ╝ýä£ DDMýØÇ ÛÀ© ý×Éý▓┤Ùí£ÙÅä Û│¿ý£áÙÅäÙèÑýØä Ù│┤ýØ┤ýºÇÙºî, rhBMP-2ýÖÇ Ýò¿Û╗ÿ ýé¼ýÜ®Ýòá ýï£ Û│¿Ýÿòýä▒ÙèÑÙáÑýØÇ Ùìö ýªØýºäÙÉá ýêÿ ý×êý£╝Ù»ÇÙí£ ý╣ÿýí░ýù┤Û│╝ Û░ÖýØ┤ ýØ┤ýïØÝò£ Û│¿ýØ┤ ýâØý░®ÝòÿÛ©░ ýû┤ÙáñýÜ┤ ÝÖÿÛ▓¢ýùÉýä£ Ùìö ÝÜ¿Û│╝ýáüý£╝Ùí£ ýä▒Û│ÁýáüýØ© Û│¿ýØ┤ýïØ Û▓░Û│╝ÙÑ╝ Ùï¼ýä▒Ýòá ýêÿ ý×êýØä Û▓âý£╝Ùí£ Û©░ÙîÇÙÉ£Ùïñ.
2023Ùàä 8ýøö, ý╣ÿýí░ýù┤Û│╝ Û░ÖýØ┤ ýäáý▓£ýáü ýòàýòêÙ®┤ Û©░Ýÿò ýï£ Û│¿ Û▓░ýåÉý£╝Ùí£ ý╣ÿÙúîÛ░Ç ÝòäýÜöÝò£ Û▓¢ýÜ░ ýï£ÝûëÝòÿÙèö ÔÇÿÛ│¿ýØ┤ýïØýêá(ý░¿114)ÔÇÖýùÉ ÙîÇÝò£ Û©ëýù¼ Û©░ýñÇýØ┤ ÛÁ¼Û░òýòàýòêÙ®┤ "ÛÁ¼Û░òýòàýòêÙ®┤ ýêÿýêá ýáê" ýùÉ ýïáýäñÙÉÿýùêÙïñ. ýØ┤Ùèö ýáäÝåÁýáüý£╝Ùí£ ýé¼ýÜ®ÝòÿÙèö ý×ÉÛ░ÇÛ│¿, ÙÅÖýóàÛ│¿, ýØ┤ýóàÛ│¿, Ýò®ýä▒Û│¿ýØä ýé¼ýÜ®Ýòá Ùòî ý▓ÿÙ░®Ýòá ýêÿ ý×êÙèö Ýûëý£äýØ┤Ùïñ. ý╣ÿýòäý£áÙ×ÿÛ│¿ýØÇ ý×ÉÛ░Çý╣ÿýòäÙÑ╝ ÝÖ£ýÜ®Ýò£ Û│¿ýØ┤ýïØýêáýùÉ ÙîÇÝò£ ÛÀ£ýáòýØ┤ ý×êÙïñ. ý╣ÿýú╝ýºêÝÖÿ ý▓ÿý╣ÿýùÉ ýé¼ýÜ®ÙÉÿÙèö ÔÇÿý×ÉÛ░Çý╣ÿýòäý£áÙ×ÿÛ│¿ýØ┤ýïØýêá(ý░¿107-1)ÔÇÖýØÇ ýäáÙ│äÛ©ëýù¼ 50%Ùí£ ýºÇýáòÙÉÿýû┤ ý×êÛ│á, ý╣ÿýí░ýù┤Û│╝ Û░ÖýØ┤ ý╣ÿýòäÛ░Ç ýùåÙèö ýòàÛ│¿ýùÉ Û│¿ýØ┤ýïØýêáýØä ýï£ÝûëÝòá Û▓¢ýÜ░ýùÉÙèö ÔÇÿÛÁ¼Û░òýòàýòêÙ®┤ÙÂÇ Û│¿ýØ┤ýïØýêá(ý×ÉÛ░Çý╣ÿýòäý£áÙ×ÿÛ│¿)ÔÇÖýØ┤ 2021Ùàä 7ýøö ýïáýØÿÙúîÛ©░ýêáÙí£ ýØ©ýáòÙ░øýòä Ù╣äÛ©ëýù¼Ùí£ ý▓¡ÛÁ¼Û░Ç Û░ÇÙèÑÝòÿÙïñ. ÛÀ©ÙáçýºÇÙºî ý×äýâüýáüý£╝Ùí£ ÝÖ£ýÜ®ÙÅäÛ░Ç ÙåÆýØä Û▓âý£╝Ùí£ Û©░ÙîÇÙÉÿÙèö ÙÅÖýóà ý╣ÿýòäý£áÙ×ÿÛ│¿(Allo-DDM)ýùÉ ÙîÇÝò£ ÛÀ£ýáòýØÇ ýòäýºü ýá£ýáòÙÉ£ Ù░ö ýùåÛ©░ýùÉ, ýØ┤ ÝÖÿý×ÉýÖÇ Û░ÖýØ┤ ý╣ÿýòäý£áÙ×ÿÛ│¿ýØÿ ýûæýØ┤ ÙÂÇýí▒ÝòÿÛ▒░Ùéÿ Ù░£ý╣ÿÝòá ý╣ÿýòäÛ░Ç ýùåÙèö Û▓¢ýÜ░ýùÉ ýé¼ýÜ®Ýòá ýêÿ ý×êÙÅäÙíØ ýï£ýèñÝà£ýØä ÙºêÙá¿Ýòá ÝòäýÜöÛ░Ç ý×êÙïñ. ýØ┤ ýªØÙíÇÙèö ý×ÉÛ░ÇÛ│¿Û│╝ ý╣ÿýòäý£áÙ×ÿÛ│¿ýØä Ýò¿Û╗ÿ ýé¼ýÜ®ÝòÿýÿÇÛ©░ýùÉ, ý╣ÿýí░ýù┤ Û│¿ýØ┤ýïØýêáýùÉýä£ ý╣ÿýòäý£áÙ×ÿÛ│¿ÙºîýØÿ ÝÜ¿Û│╝ÙÑ╝ ýáòÝÖòÝ×ê ÝÅëÛ░ÇÝòÿÛ©░Ùèö ýû┤ÙáÁÙïñ. ÝûÑÝøä ý╣ÿýòäý£áÙ×ÿÛ│¿ÙºîýØä Ùï¿ÙÅàý£╝Ùí£ ÝÖ£ýÜ®Ýò£ ý╣ÿýí░ýù┤ ýêÿýêáýùÉ ÙîÇÝò£ Ýøäýåì ýù░ÛÁ¼Û░Ç ÝòäýÜöÝòÿÙïñ. Ýè╣Ý×ê, ý╣ÿýí░ýù┤ ÝÖÿýòäÙèö ý®ÙÂäÝò£ ýûæýØÿ ý×ÉÛ░Çý╣ÿýòäý£áÙ×ÿÛ│¿ýØä ýû╗Û©░ ýû┤ÙáÁÛ©░ ÙòîÙ¼©ýùÉ ÙÅÖýóàý╣ÿýòäý£áÙ×ÿÛ│¿ýØä ÝÖ£ýÜ®Ýòá ÝòäýÜöÛ░Ç ý×êýØä Û▓âý£╝Ùí£ ýé¼ÙúîÙÉ£Ùïñ.
ýáäÝåÁýáüýØ© Ù░®ýïØýØÿ ýáäÙ░®ý×ÑÛ│¿ÙèÑÛ│╝ Ýò¿Û╗ÿ ýé¼ýÜ®Ýò£ rh┬¡BMP-2Û░Ç ý¢öÝîàÙÉ£ ý╣ÿýòäý£áÙ×ÿÛ│¿ýØä ÝÖ£ýÜ®Ýò£ ý╣ÿýí░ýù┤ Û│¿ýØ┤ýïØ ýêÿýêá Ýøä ýòêýáòýáüýØ© Bone bridgeÛ░Ç Ýÿòýä▒ÙÉ£ Û▓░Û│╝ÙÑ╝ Ù│┤Û│áÝò£Ùïñ. ÙïñýûæÝò£ Ù¼©ÝùîÙôñýùÉýä£ ý╣ÿýòäý£áÙ×ÿÛ│¿ýØä ÝÖ£ýÜ®Ýò£ ý╣ÿýí░ýù┤ ýêÿýêáýØÿ ýä▒Û│ÁýáüýØ© Û▓░Û│╝ÙÑ╝ Ù│┤Û│áÝòÿÛ│á ý×êÙèö ÙºîÝü╝, ýò×ý£╝Ùí£ÙÅä ý╣ÿýòäý£áÙ×ÿÛ│¿ýØä ÝÖ£ýÜ®Ýò£ ý╣ÿýí░ýù┤ Û│¿ýØ┤ýïØýêÿýêáýùÉ ÙîÇÝò£ ý×äýâü ýù░ÛÁ¼Û░Ç ÝòäýÜöÝòá Û▓âý£╝Ùí£ Ù│┤ýØ©Ùïñ
Figure 3.
ýáäÙ░® ý×ÑÛ│¿ÙèÑ ý▒äýÀ¿ ýêÿýêá. A. ýáäÙ░® ý×ÑÛ│¿ÙèÑ, ýáäýâüý×ÑÛ│¿ÙÅîÛ©░, ýáêÛ░£ýäáýØÿ ÙÅäÝò┤. B. ý×ÑÛ│¿ÙèÑýØä Ùà©ý£ýï£ý╝£ Û│¿ý▒äýÀ¿ÙÑ╝ ý£äÝò£ Û│¿ýáêÛ░£ ýï£Ýûë. C. ý▒äýÀ¿Ýò£ ý×ÑÛ│¿ÝÄ© D. Ù░░ýòíÛ┤Ç ý▓ÿý╣ÿýÖÇ ýØ╝ý░¿ Ù┤ëÝò® Ùï¼ýä▒
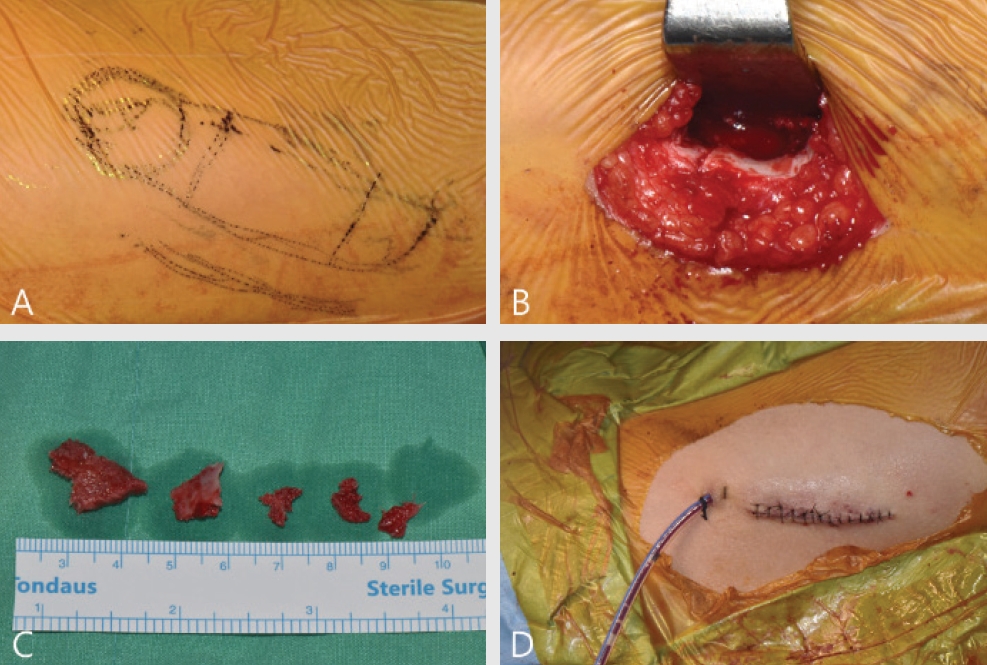
Figure 4.
ý╣ÿýí░ýù┤ Û│¿ýØ┤ýïØ ýêÿýêá. ý╣ÿýí░ýù┤ ÙÂÇý£ä Û│¿ýØ┤ýïØýØä ý£äÝò£ preparation (A: ýóîý©í ý╣ÿýí░ýù┤, B: ýÜ░ý©í ý╣ÿýí░ýù┤). C. ý×ÑÛ│¿ÙèÑÛ│╝ ý╣ÿýòäý£áÙ×ÿÛ│¿ýØä ýáüýáêÝ×ê Ýÿ╝Ýò®Ýòÿýù¼ Û│¿ýØ┤ýïØý×¼ÙÑ╝ Û▓░ýåÉÙÂÇ ýØ┤ýïØÝò£ Ù¬¿ýèÁ. D. Fibrin sealantÙÑ╝ ÙÅäÝżÝòÿýù¼ ýºÇÝÿêý▓ÿý╣ÿýÖÇ Û│¿ýØ┤ýïØý×¼ýØÿ ýòêýáòýä▒ýØä ÝÖòÙ│┤Ýò£ Ù¬¿ýèÁ. E. ýáÉÙºë ýáêÛ░£ÙÑ╝ ýù░ý×ÑÝòÿýù¼ ýóîý©í Û│¿ýØ┤ýïØÙÂÇý£äýØÿ ýØ╝ý░¿Ù┤ëÝò®ýØä Ùï¼ýä▒Ýò£ Ù¬¿ýèÁ. F. Û│¿Ùºë ýáêÛ░£Ùí£ Ýö╝ÝîÉýØä ýáäÙ░®ý£╝Ùí£ ýù░ý×ÑÝòÿýù¼ ýØ╝ý░¿ Ù┤ëÝò®ýØä Ùï¼ýä▒Ýò£ Ù¬¿ýèÁ.
REFERENCES
1. ÙîÇÝò£ÛÁ¼Û░òýòàýòêÙ®┤ýÖ©Û│╝ÝòÖÝÜî. ÛÁ¼Û░òýòàýòêÙ®┤ýÖ©Û│╝ÝòÖ ÛÁÉÛ│╝ýä£. 4th ed. ÛÁ░ý×Éý£ÝîÉýé¼, 2023.
2. Dissaux C, Ruffenach L, Bruant-Rodier C, George D, Bodin F, Remond Y. Cleft Alveolar Bone Graft Materials: Literature Review. The Cleft Palate Craniofacial Journal 2022;59:336ÔÇô46.


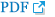
3. Osorio CC, Escobar LM, Gonzalez MC, Gamboa LF, Chambrone L. Evaluation of density, volume, height and rate of bone resorption of substitutes of autologous bone grafts for the repair of alveolar clefts in humans: A systematic review. Heliyon 2020;6:e04646.



4. Alkaabi SA, Alsabri GA, NatsirKalla DS, Alavi SA, Mueller WEG, Forouzanfar T et al. A systematic review on regenerative alveolar graft materials in clinical trials: Risk of bias and metaanalysis. Journal of Plastic, Reconstructive & Aesthetic Surgery 2022;75:356ÔÇô65.


5. Yeomans JD, Urist MR. Bone induction by decalcified dentine implanted into oral, osseous and muscle tissues. Arch Oral Biol 1967;12:999ÔÇô1008.


6. Hara S, Mitsugi M, Kanno T, Tatemoto Y. Bone transport and bone graft using auto-tooth bone for alveolar cleft repair. J Cra┬¡niofac Surg 2013;24:e65ÔÇô8.

7. Matsuzawa Y, Okubo N, Tanaka S, Kashiwazaki H, Kitagawa Y, Ohiro Y et al. Primary Teeth-Derived Demineralized Dentin Ma­trix Autograft for Unilateral Maxillary Alveolar Cleft during Mixed Dentition. J Funct Biomater 2022;13.

8. Jang K-Y, Lee J-H, Oh S-H, Ham B-D, Chung S-M, Lee J-K et al. Bone graft materials for current implant dentistry. Journal of Dental Implant Research 2020;39:1ÔÇô10.

9. Zins JE, Whitake LA. Membranous versus endochondral bone: implications for craniofacial reconstruction. Plast Reconstr Surg 1983;72:778ÔÇô85.

10. Bessho K, Tanaka N, Matsumoto J, Tagawa T, Murata M. Hu┬¡man dentin-matrix-derived bone morphogenetic protein. J Dent Res 1991;70:171ÔÇô5.


11. Khang G. Handbook of intelligent scaffolds for tissue engineer­ing and regenerative medicine. CRC Press, 2017.
12. Kim Y, Ku JK, Um IW, Seok H, Leem DH. Impact of Autoge­nous Demineralized Dentin Matrix on Mandibular Second Molar after Third Molar Extraction: Retrospective Study. J Funct Bio­mater 2022;14.

13. Mahardawi B, Jiaranuchart S, Tompkins KA, Pimkhaokham A. Efficacy of the autogenous dentin graft for implant placement: a systematic review and meta-analysis of randomized controlled trials. Int J Oral Maxillofac Surg 2023;52:604ÔÇô12.


14. Ku JK, Kwak HW, Um IW. Incorporating Moldable Demineral­ized Dentin Matrix into Treatment for a Jaw Cyst. J Funct Bio­mater 2023;14.

15. Um IW, Lee JK, Kim JY, Kim YM, Bakhshalian N, Jeong YK et al. Allogeneic Dentin Graft: A Review on Its Osteoinductivity and Antigenicit. Materials (Basel) 2021;14.
17. Um IW, Ku JK, Kim YK, Lee BK, Leem DH. Histological Review of Demineralized Dentin Matrix as a Carrier of rhBMP-2. Tissue Eng Part B Rev 2020;26:284ÔÇô93.



18. Um IW, Ku JK, Lee BK, Yun PY, Lee JK, Nam JH. Postulated release profile of recombinant human bone morphogenetic protein-2 (rhBMP-2) from demineralized dentin matrix. J Ko┬¡rean Assoc Oral Maxillofac Surg 2019;45:123ÔÇô8.



-
METRICS

-
- 0 Crossref
- 0 Scopus
- 1,098 View
- 16 Download
- ORCID iDs
-
Jeong-Kui Ku

https://orcid.org/0000-0003-1192-7066Jin-A Baik

https://orcid.org/0000-0001-6326-0828 - Related articles
-
Considerations for implant surgery in disabled patients with medical history2023 August;61(8)
Bone graft of alveolar bone defects using rhBMP-22015 January;53(1)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print