치주성형수술(periodontal plastic surgery)의 임상적 접근
Clinical approach to periodontal plastic surgery: A narrative review
Article information
Trans Abstract
Periodontal plastic surgery (PPS) encompasses surgical procedures aimed at correcting anatomical deficiencies such as inadequate width and thickness of attached gingiva, gingival recession (GR), aberrant frenulum attachment, and shallow vestibular depth. The primary objectives of PPS are to ensure sufficient width and thickness of keratinized gingiva, manage GR through root coverage of exposed root surfaces, deepen the vestibule for functional improvement, and enhance esthetic outcomes and patient satisfaction. This review presents a comprehensive summary of the fundamental concepts, major surgical techniques, and recent advances in PPS that are essential for clinical practice.
서론
치주성형수술(periodontal plastic surgery; PPS)은 부착치은의 폭과 두께 증가, 치은퇴축(gingival recession; GR)의 회복, 비정상적인 소대 부착, 전정 부위의 협소와 같은 해부학적 문제를 개선하기 위한 외과적 술식이다. Friedman이 1957년에 '치조점막문제(mucogingival problem)'라는 용어를 도입하였으며, 이후 1996년 국제학회인 Proceedings of the World Workshop in Periodontics에서 Miller가 제안한 바에 따라, 치은·치조점막수술이 '치주성형수술(PPS)'이라는 용어로 정의되었다[1,2].
치주성형수술의 주요 목적은 다음과 같다: 각화치은(keratinized gingiva, KG)의 충분한 폭과 두께 확보, 치은퇴축의 치료 및 노출된 치근의 피개(root coverage, RC), 전정부의 심화와 기능 향상, 심미적 개선 및 환자 만족도 향상.
초기에는 측방변위판막술(laterally positioned flap; LPF), 유리치은이식술(free gingival graft; FGG) 등이 시행되었으며, 이후 결합조직이식술(connective tissue graft; CTG), 치관측 피판술(coronally advanced flap; CAF), 터널술식(tunnel technique)이 도입되며 PPS로 발전하였다. 특히 Miller의 치은퇴축의 분류와 그에 따른 맞춤 술식은 이 분야의 진보에 중요한 기여를 하였다[3].
본 종설에서는 치주성형수술의 핵심 개념과 임상 적용을 중심으로, 주요 수술 술식 및 최신 경향을 종합적으로 정리하여 임상가가 반드시 이해해야 할 내용을 제시하고자 한다.
본론
치은증강술(gingival augmentation procedures)
치은증강술의 목적은 치은 건강을 증진하고 부착 수준을 개선하기 위해 각화치은의 폭을 증가시키는 데 있다. 각화치은이 부족한 부위는[1] 변연조직이 쉽게 움직여 치주낭의 완전한 폐쇄가 어렵고[2], 치은병소가 근단으로 확산되기 쉬워 부착상실 및 연조직 퇴축이 쉽게 일어난다. 그러나 각화치은의 필요성에 대해서는 여전히 논란이 있다[3,4]. 일부 연구에서는 각화치은의 폭이 2mm 미만인 경우, 치아 또는 치근형 인공치아(임플란트)에 악영향을 미친다고 보고하였으나, 다른 연구에서는 각화치은의 유무가 치은염 또는 임플란트 주위 점막염과 연관되지 않는다고도 하였다[5,6].
각화치은을 증대시키기 위해 다양한 술식이 임상적으로 사용되고 있으며, 대표적으로 근단변위판막술(apically positioned flap; APF), 콜라겐 매트릭스(collagen matrix; CM), 유리치은이식술(free gingival graft; FGG) 등이 있다[7,8]. Lin 등[9]은 이러한 술식들이 성숙하고 안정적인 연조직 형성에 기여한다고 보고하였다. 주요 술식들은 다음과 같다[10].
1. 치은확장술(gingival extension procedure)
각화치은을 형성하기 위해 치조골을 노출시키는 술식이다. 하지만, 치조골 노출로 인해 골소실 또는 치은퇴축이 발생할 수 있어 현재는 거의 사용되지 않는다.
2. 근단변위판막술(apically positioned flap; APF)
부분층 판막을 형성한 후 근단 방향으로 변위시켜 치주낭을 제거하고 각화치은의 폭을 넓히는 술식이다. 골막은 보존하면서 치조골을 노출시키지 않기 때문에, 골흡수나 치은퇴축의 위험이 감소된다. 특히, 대구치 부위는 전치부보다 각화치은의 폭이 좁으며, 발치, 골이식, 임플란트 식립 과정에서 각화치은이 점차 감소할 수 있다. 이런 경우 보철 수복 시 칫솔질 시 협측 불편감을 호소하는 환자가 많으며, 따라서 임플란트 2차 수술 시 근단변위판막술을 통해 각화치은을 확보하는 것이 유리하다(Fig. 1A)

A. 절개를 한 후(노란색 선), 치조정의 하방 2mm 이상의 위치(초록색 선)를 잡고, 여기에 고정을 시키면, 노출된 골막과 결합조직에 의해서 새로운 각화치은이 형성된다. B-M. 임플란트주위염(peri-implantitis)에 이환된 임플란트 주변의 각화 치은을 증가시키기 위한 세 가지의 외과적 치료 방법의 임상 사진. CM: collagen matrix (B-E), APF: apically positioned flap. (G–L), FGG: free gingival graft, M–R, N:수직적 각화치은의증대량, 술전(T0), 술후30일(T1), 60일(T2), 90일(T3), 180일(T4) (Lee et al, 2020)
3. 치은이식술(gingival graft)
각화치은의 증대 또는 치근피개를 목적으로 시행된다. 술식의 순서는 다음과 같다. 첫째, 치은점막경계 부위에서 약간 각화치은 방향으로 수평 절개를 한다. 둘째, 골막은 유지한 채 예개(sharp dissection) 후 수직 절개를 통해 치조점막까지 접근한다. 셋째, 부분층 판막을 형성하며, 수여부 면적은 이식편보다 약 25% 크게 형성한다. 필요시, 골막천공(periosteal fenestration)을 추가할 수 있다.
공여 부위는 일반적으로 견치부 원심부터 제2대구치 근심까지의 구개부 점막이다. 이식편 채취 후, 지방조직이 동반된 경우 가위 또는 외과용 수술칼(No. 15)을 사용하여 제거하고, 수여부에 접합 후 봉합한다. 그 치유과정은 다음과 같다.
초기(0–3일): 이식편과 수여부 사이의 긴밀한 접착이 중요하다. 이 시기에는 수여부에서 무혈관성 혈장 순환(plasmatic circulation)을 통해 이식편에 영양이 공급된다.
맥관재생기(2–11일): 4–5일째부터 이식편과 수여부 간 문합(anastomosis)이 시작되며, 혈류 재형성과 함께 이식편과 하부 결합조직 사이에 섬유성 결합(fibrous union)이 형성된다. 인접 조직의 상피가 증식하면서 재상피형성(re-epithelization)이 일어난다.
조직성숙기(11–42일): 이식편의 혈관계(vascular system)가 정상적으로 형성되고, 각화상피도 재생되어 조직이 성숙된다[2,10].
각화치은을 증가시키는 술식은 임플란트 주위염 치료에도 적용될 수 있다. Lee 등은 임플란트 주위염이 있는 임플란트의 협측 각화치은을 증진시키기 위해 근단변위판막술, 유리치은 이식술, 콜라겐 매트릭스(collagen matrix; CM) 이식술을 시행한 후 그 결과를 평가하였다. 그 결과, 유리치은이식술이 가장 안정적인 결과를 보였으며, 각화치은의 증가량도 가장 많았다. 콜라겐 매트릭스는 심미성 측면에서 우수하였고, 환자의 통증 및 수술 시간 감소에도 기여하였다. 임플란트 주위염이 있는 경우, 협측 골흡수가 동반되면 이식편이나 콜라겐 매트릭스를 협측 골막에 안정적으로 고정하기 어려워 각화치은의 증대에 한계가 있다[11] (Figs. 1B-N).
치근피개술식(root coverage procedure; RC)
치근피개술은 기능 회복과 심미성 개선이라는 장점을 동시에 얻기 위해, 수술 기법, 이식편 채취 방법, 동종/이종 생체재료의 개발을 통해 발전해왔다. 치은퇴축은 심미적 문제뿐 아니라 노출된 치근면의 민감증 및 우식 위험 증가를 초래한다. 이술식의 성공여부는 술자의 숙련도, 치은의 형태와 두께, 환자의 구강위생에 따라 결정된다.
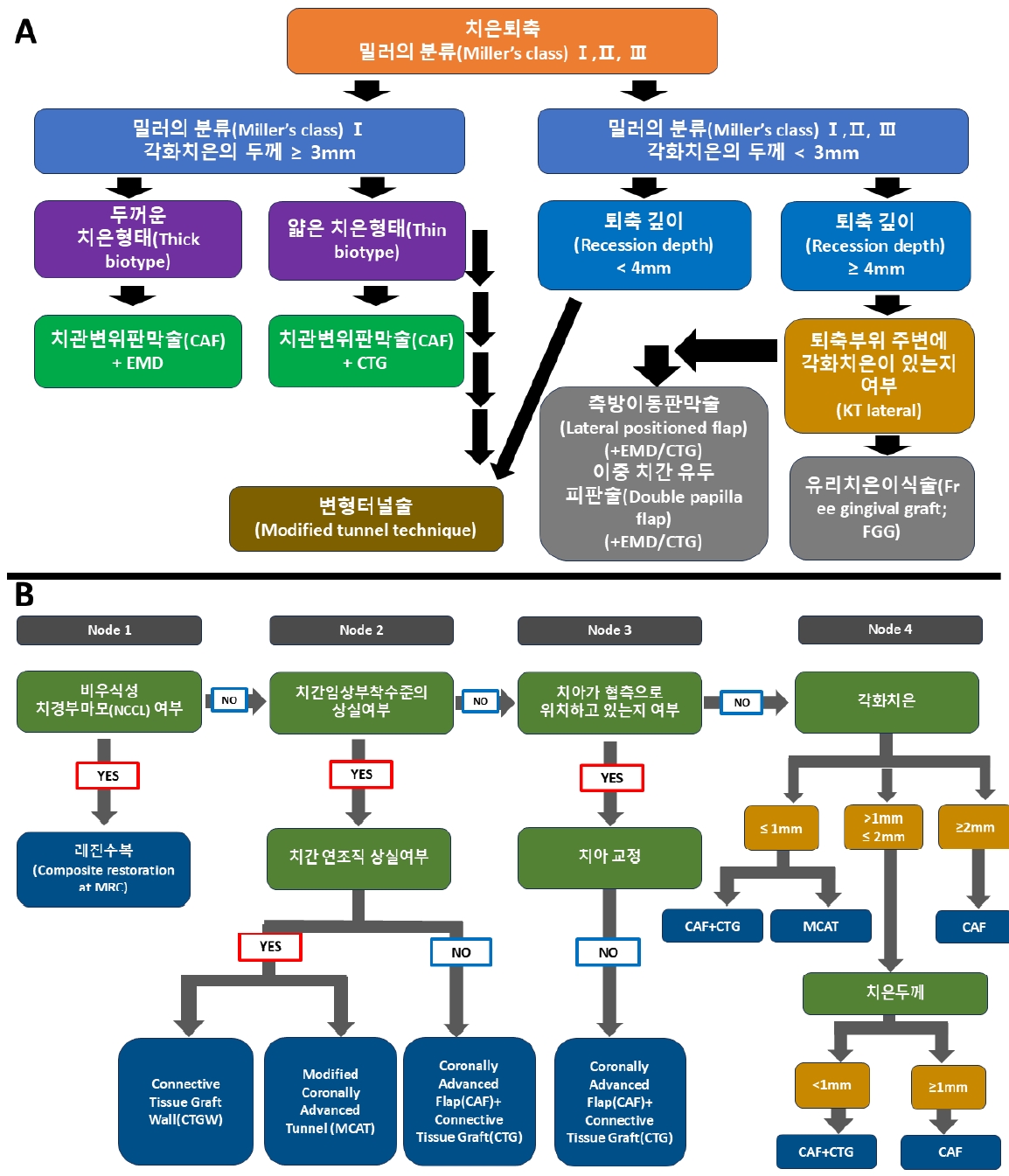
Miller는 치은 퇴축을 아래와 같은 4가지 타입으로 분류를 하였다[2,10].
Class Ⅰ: 변연 조직 퇴축이 치은점막 경계부까지 연장되지 않은 경우. 치간골이나 연조직 상실없음.
Class II: 치은점막 경계부까지 퇴축이 연장된 경우 치간골이나 연조직 상실없음.
Class III: 치은점막 경계부까지 퇴축이 연장된 경우. 치간골이나 연조직이 백악법랑경계부까지 상실되어 있으나 퇴축된 연조직 변연보다는 치관쪽에 존재함.
Class IV: 치은점막 경계부까지 퇴축이 연장된 경우. 치간골과 연조직이 상실되어 퇴축 변연보다 치간골과 연조직변연이 더 치근단 쪽으로 존재함.
Class Ⅰ과 II는 높은 치근피개율을 기대할수 있으나, Class III는 부분적인 피개율만 가능하다 Class IV는 예후가 불량하다. 따라서 치근인접면의 치주조직의 안정성이 치근피개의 결과에 큰 영향을 준다. 치근피개술을 위한 술식들은 다음과 같다.
1. 측방변위판막술(laterally positioned flap; LPF)
치주질환에 의해 노출된 치아면을 덮어주기 위해서 또는 각화치은의 양을 증가시키기 위해서 사용되는 술식이다 (Fig 2A).
2. 치관변위판막술(coronally advanced flap; CAF)
점막의 조직은 탄력성이 있어 치은치조경계를 넘어 박리하여 판막을 형성하면, 이를 이용해 노출돈 치근면을 덮을 수 있다. 치관변위판막술은 한 치아나 여러 치아에서 퇴축이 얕고 치주낭이 없는 부위의 치료에 적합하다(Fig 2B).
3. 상피하결합조직이식술(subepithelial connective tissue graft; SCTG or CTG)
상피하결합조직 이식술은 결합조직 이식편으로 노출된 치근면을 덮고, 그 위에 판막을 치관 방향으로 당겨 위치시키는 술식이다. 다른 방식으로는, 이식편을 ‘envelope’ 내에 삽입하여 치은연 상방의 노출된 치근면을 이식편 일부로 덮는 방법도 있다. 상피하결합조직 이식술은 구개부에서 ‘trap door’ 방식으로 채취하며, 일반적인 치은이식술보다 덜 침습적이고 심미적인 결과도 우수하다고 평가된다.
치근피개술에 관련된 모든 술식들은 완전한 치근피개를 달성할 수 있다고 하였다. 특히, 1-2mm 깊이정도의 퇴축일 때는 높은 수준의 완전치근피개를 달성할 수가 있다. 특히, 치관변위판막술(CAF)+상피하결합조직이식술(CTG)은 치근피개술의 골드스탠다드(gold standard)로 간주된다[12,13]. (Figs. 2C-F).
Stein 등은 Miller 분류법에 따라, Stefanini 등은 치경부우식 및 각화치은여부에 따라 decision tree를 제시하였다[14,15] (Fig. 3).
소대절제술(frenectomy) 및 소대성형술(frenuloplasty)
소대(frenum)가 변연치은에 가깝고 높은 위치에 부착되어 있는 경우, 건강한 치은을 지속적으로 견인하여 치주질환의 국소적 원인인자가 축적될 수 있다. 이는 부착소실을 악화시키고, 수술 후 치근면과의 밀착을 방해하며, 환자의 구강 위생 유지에도 장애를 초래한다. 이러한 경우, 소대의 부착부를 포함하여 하부 치조골에 부착된 소대를 완전히 절제하는 것을 소대절제술(frenectomy)이라 하고 소대에 절개를 가해, 소대를 부분적으로 제거하는 경우를 소대부분절제술(frenotomy) 이라 한다. 이들 술식은 치주낭 제거수술과 병행하여 시술하기도 하고 단독으로 시행되기도 한다.
치근피개술을 하면서, 소대성형술(frenuloplasty)을 하는 경우, 다음과 같은 임상적인 이점을 기대할 수 있다. 1) 얕은 전정과 높은 소대 부착 문제를 한 번의 수술로 해결 2) CTG의 혈류 공급(vascularization)을 보호하여 치유를 최적화, 3) 전정 깊이를 증가시키고 소대의 긴장력을 완화하여 장기적인 안정성의 증가[16] (Fig. 4).
구강전정성형술(vestibuloplasty)
구강전정의 깊이는 임상적으로 중요하다. 구강전정이 얕은 경우, 구강위생 관리의 어려움뿐 아니라, 지속적인 궤양(ulceration) 및 염증의 원인이 될 수 있다. 또한, 구강전정이 얕으면, 치근피개술의 결과가 만족스럽지 않을 수 있다는 결과도 보고되었다[17].
1. 골천공을 이용한 구강전정성형술
2. 치은이식술을 이용한 구강전정성형술
천공술을 이용한 구강전정형성술의 술식과 동일하게 시행하나,구강전정이 형성된 부위에 천공을 시행하지 않고, 치은이식편을 노출된 수술부위의 골막에 위치시키는 방법이다(Figs. 4F-J).
치주성형술식시 고려사항
1. 공여부위의 처치
구개부에서 이식편을 채취한 후 공여부를 어떻게 처치하느냐에 따라, 술 후 환자의 불편감 완화 및 출혈 조절에 영향을 줄 수 있다. 공여부에 지혈제를 적용한 뒤 봉합하는 방법이나, 구개 스텐트(palatal stent)를 제작하여 술 후 착용하게 하는 방법이 일반적으로 사용된다. 최근 연구에 따르면, 구개 스텐트를 착용한 경우 환자가 느끼는 통증의 정도와 진통제의 소비량이 가장 낮았으며, 동일 술식을 다시 받을 의향도 가장 높게 나타났다. 이 외에도 시아노아크릴레이트(cyanoacrylate) 또는 혈소판농축섬유소(platelet-rich fibrin; PRF)를 적용하는 방법 또한 통증 감소에 효과적인 것으로 보고되었다[18] (Figs. 5A-D).
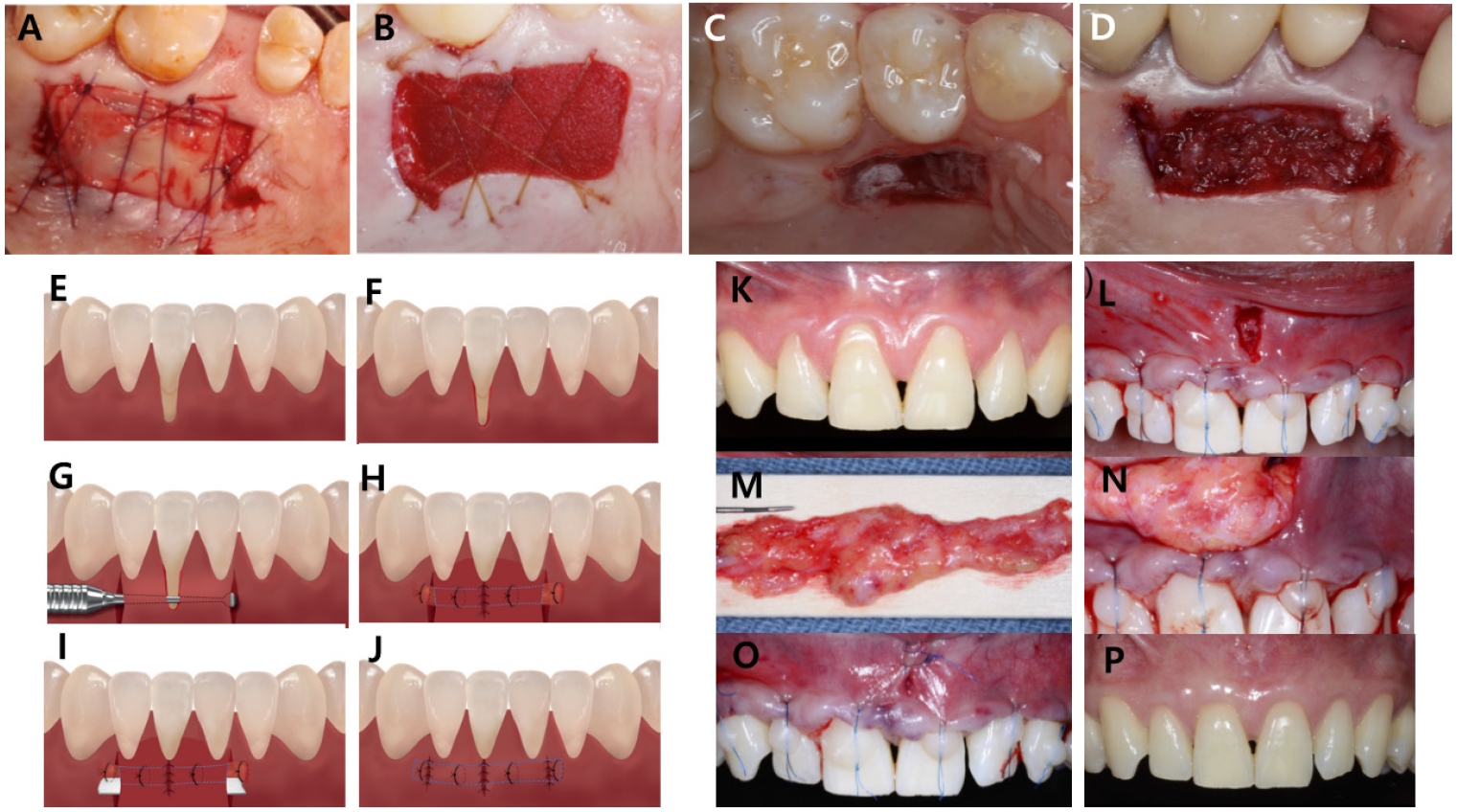
A. 혈소판 풍부 섬유소(platelet-rich fibrin, PRF). B. 콜라겐스펀지. C. 구개부 스텐트(Palatal stent). D. cyano-acrylate. (Basma et al, 2022). Modified tunneling technique (E-J). E. 하악 전치부의 치은퇴축. F. 치은퇴축 부위를 둘러싼 변연 치은의 상피 제거. G. 치간의 전정부 수직 절개 후, 외과용 큐렛을 사용하여 골막하 터널링 시행. H. 상피하결합조직(CTG) 적용 후 고정. I. CTG하방에 콜라겐매트릭스(Collagen matrix) 적용. J. 전정절개부위 봉합 (Kim et al, 2024). Vestibular incision subperiosteal tunnel access(VISTA) (K-P). K. 수술 전 상태. J. 초기 전정 수직 절개. M.골막하 터널을 거상하고, 각 치아의 협측 표면에 봉합사를 접착 이후 치은 변연을 치관측으로 이동. L. 구개에서 CTG를 채취. N.해당 이식편을 수직 절개선을 따라 근심-원심 방향으로 고정. O. 초기 절개부 봉합. P. 12개월 추적 관찰 결과 (Gil et al, 2018).
2. Creeping attachment
Creeping attachment란, 상피하결합조직 이식술나 유리치은 이식술 후 치은조직(gingival tissue)이 시간이 지나면서 치관방향으로 점진적으로 이동하여 치근면을 추가로 피개하는 현상을 말한다. 이와 같은 현상은 섬유모세포(fibroblast)의 부착 기전의 이동(movement of attachment apparatus)와 과잉치유(overhealing)로 인하여 발생하는 것으로 알려져 있다[19]. Creeping attachment는 일반적으로 두꺼운 잇몸형태 (thick biotype), 자연치에서 잘 발생하며, 글라스아이오노머(Glass ionomer), 복합 레진(composite resin), 플랫폼 스위칭(platform switching) 형태의 임플란트 표면에서도 잘 관찰된다[20,21].
3. 장기적인 예후
상피하결합조직이식술(CTG)을 이용하는 경우 장기적인 예후가 우수하다는 연구결과가 다수 보고되었다. Cairo 등은 치관변위판막술 단독 술식과 ‘치관변위판막술(CAF) + 상피하결합조직이식술(CTG)‘ 병합 술식을 비교한 10년 후 재평가 연구에서, CAF + CTG 그룹이 완전 치근피개율(complete root coverage, cRC)과 치은 변연 안정성 측면에서 더 우수한 결과를 보였다고 보고하였다. CAF + CTG 그룹에서는 cRC가 63%로 유지된 반면, CAF 단독 그룹에서는 20%에 불과하였다[22].
또한, 이식된 부위의 치은 변연은 최대 11년까지 안정적으로 유지되었으나, 그 이후에는 치은퇴축이 재발하는 경향이 나타났다. 다만, 21년이 경과하면 치은퇴축의 재발 경향은 감소하는 양상이 관찰되었다[23].
4. 심미적인 환자의 만족도
치료를 받은 환자의 주관적인 만족도 역시 중요한 평가 요소이다. 한 연구에 따르면, 술 후 치근피개율이 약 80%인 경우 환자들은 ‘매우 만족’이라고 표현한 반면, 약 67%인 경우에는 ‘매우 불만족’이라고 응답하였다. 따라서 술식 시행 전, 기대되는 피개 정도에 대한 예측과 환자의 만족도 간의 연관성을 고려하고, 이에 대해 사전에 충분히 설명하는 과정이 필요하다[24].
5. 발생할 수 있는 합병증
치주성형수술 시행 시 발생할 수 있는 일반적인 합병증으 로는 통증, 출혈, 부종, 이식편 괴사 등이 있다. 특히 공여부는술 후 1주일까지 주의가 필요하다. 회복 과정 중 거칠거나 날카로운 음식물이 공여부를 자극할 경우, 상당한 출혈이 발생할 수 있다 [25].
이외의 비정상적인 합병증으로는 Alarcon 등의 체계적 문헌 고찰(systematic review)에 따르면, 골증대(bone exostosis), 상피 함입(epithelial inclusion), 변색(discoloration), 재혈관화(revascularization), 재상피화(re-epithelialization) 등이 보고되었다. 또한, 상악 제2대구치 부위에서 상피하결합조직 이식술 중 구강상악누공(oroantral communication)이 발생한 사례도 보고된 바 있다. 따라서 임상가는 드물게 발생할 수 있는 합병증에 대한 가능성을 인지하고, 이에 대한 정확한 진단 및 적절한 처치 방법을 숙지해야 한다[26].
최신경향
1. 새로운 술식
Lee 등은 ‘변형터널술식 (modified tunneling technique)’에 대하여 소개하였다. 이는 치은퇴축 부위에 터널을 형성한 후, 치은이식편(gingival graft)과 콜라겐 매트릭스(collagen matrix; CM)를 상·하부에 삽입하는 술식이다(Figs. 5E–J). 해당 연구에서는 본 술식이 Miller Class I에 해당하고 치은퇴축 깊이가 6 mm 이하인 경우에 유효하며, 이식편의 크기를 최소화하면서도 치은 볼륨을 효과적으로 증가시킬 수 있다고 보고하였다[27]. 이후 Han 등은 이 술식에 대한 평균 41.3개월의 추적 결과를 통해 장기적인 안정성을 확인하였고, 경과 기간 중 치근피개율이 점진적으로 증가하여, 61개월 이상 경과 시에는 97.6%까지 도달함을 보고하였다. 이러한 결과는 치은이 점진적으로 치근을 덮어가는 creeping attachment 현상이 발생했음을 시사한다[28].
Vestibular incision subperiosteal tunnel access (Vista) 기법은 협측 순소대(frenum) 부위 및 전정부에 수직 절개를 가한 후, 절개 부위에 골막하 터널(subperiosteal tunnel)을 형성하여 퇴축된 치은 및 인접치의 치은연까지 접근하는 방법이다(Figs. 5K–P). 이 술식의 장점은 치은연에 직접 절개를 가하지 않기 때문에 심미성과 혈류 보존에 유리하며, 치유의 예측성도 높다는 것이다. 최근 Matvijenko 등은 VISTA 기법이 다수의 치은퇴축을 심미적이고 최소침습적으로 치료할 수 있는 효과적인 술식이라고 보고하였다[29].
2. 새로운 재료의 도입
상피하결합조직술은 치근피개나 치은증강을 위한 골드 스탠다드(gold standard)로 널리 인정되지만, 이식편 채취에 따른 환자의 불편감 및 수술 부위의 합병증이 발생할 수 있다[30].
이러한 이유로, 무세포 진피 매트릭스(acellular dermal matrix, ADM), 콜라겐 매트릭스(CM)볼륨 안정성 콜라겐 매트릭스 (volume-stable collagen matrix, VCMX)와 같은 연조직 대체재들이 도입되어, 환자의 불편을 최소화하고 공여 부위의 합병증 위험을 줄이려는 노력이 이어지고 있다[31]. 최근 연구에서는 임플란트 식립과 함께, 협측열개 부위에 상피하결합조직술과 VCMX을 적용했을 때, VCMX는 초기 증대량과 임상 지표에서 결합조직과 유사한 결과를 보였고, 환자 만족도는 더 높았다[32].
또한, 치은이식술을 시행하면서 성장인자(growth factor)를 병용하는 시도도 보고되고 있다.
Hyaluronic acid(HA)는 혈병(bood clot)형성의 촉진, 혈관 신생(angiogenesis) 등의 장점이 있다. 치관변위판막술을 하면서 HA를 함께 적용한 경우, 연조직 회복에 더 좋은 결과를 보였다[33]. 또한, polydeoxyribonucleotide(PDRN)은 항염증성 Interleukin(IL)-10의 증가와 염증성 인자인 tumor necrosis factor-alpha(TNF-α)의 감소에 의한 재상피화(re-epithelialization)를 촉진한다. PDRN을 콜라겐 매트릭스(CM)과 적용한 전임상실험 결과, 치은증대와 (CM+PDRN vs CTG) 각화조직 재생에 있어 (CM+PDRN vs FGG)에 비해서 열등하지 않다는 결과를 보였다 34) . Activin/BMP-2 chimera(AB204)를 사용하여 연조직의 회복을 시도한 연구도 있었다. Han 등은 전임상실험을 통해서, 협측 골소실부위에 AB204와 CM을 이식한 경우(CM/AB204), CM 단독으로 사용한 것 보다, 2주차에 치은두께가 더 증가하였고, 조직학적으로 새로운 치조골, 치주 인대, 백악질이 형성된 것이 관찰되었다[35].
하지만, 이러한 연조직 대체재와 성장인자들은 아직, CTG나 FGG에 비해서는 조직안정성과 골수준의 유지에 월등한 우수성을 보이지 않기 때문에, 추가적인 연구가 필요하다.
3. 신의료기술
Melsen과 Allias등은 치은의 염증과 얇은 치은유형(thin biotype)이 치은퇴축의 중요한 요인이라고 하였고[36], Yared 등은 퇴축된 치은을 가진 치아의 93%가 0.5mm 미만의 치은 두께를 가진다고 하였다[37]. 치은두께와 치근피개율과의 관계를 위한 메타회귀(meta-regression) 연구에서, 치은두께가 치근피개율에 영향을 미친다는 결과도 있었다[38].
이를 위해서, 치은의 두께를 증가시키고, 치은퇴축 치료의 목적으로, 최근에는 ‘가교처리된 부피 안정화 콜라겐 매트릭스를 이용한 치은 연조직 증대술’ 이라는 기술이 신의료기술로 등재되었다. 가교 처리된 부피 안정화 콜라겐 매트릭스를 치은 이식 부위에 삽입하고 수여부를 봉합하는 방법으로, 자가 치은 이식술과 비교시 연조직 두께와 부피증대, 각화 치은 폭경유지, 및 통증 개선 정도가 유사한 수준으로 유용한 기술이라고 평가되었다 [39].
4. 디지털의 적용(digital technique)
연조직 증대와 치은퇴축에 대한 치료를 위한 디지털 적용은 크게 2가지로 나뉜다. 첫번째는 수술과정의 장치의 제작, 두번째는 수술 후 연조직 볼륨이나 치은피개율의 평가방법으로 사용된다.
첫번째, 수술과정의 장치제작은, 심미적 치관확장술시 수술용 가이드 템플릿(surgical guide template)을 설계 및 제작함으로써 가능하다. 특히, 심미성이 필요한 전치부 영역에서는, 절개 위치를 가이드 템플릿을 통해 정확하고, 신속하게 설정할 수 있어 임상적 편의성을 높일 수 있다(Figs. 6A-E).

A. 콘빔전산화단층영상에 중첩된 수술 가이드의 디자인. B. 치은절제술과 골삭제술의 절개선을 포함한 수술 디자인. C. 수술 전 surgical guide 장착. D. 전층 피판 거상 후, 수술 가이드가 제 위치에 장착된 상태로 골삭제술의 절개선이 표시된 모습. E. 골절제 (Mendoza-Azpur et al, 2022) F and G. 중첩 전후의 스캔된 STL file. H. 중첩된 스캔된 모델상의 선형측정방법. I. 중첩된 모델상의 체적측정방법
두번째, 광학스캔(optical scan)을 통해서 얻은 sterolitho graphy(STL) file을 중첩(superimposition)하여 3차원 분석 소프트웨어를 통해서 연조직 변화를 정량적으로 평가할 수 있다. 과거에는 구강내에서 인상채득을 통해 구강모형을 스캔하는 간접 방식이 일반적이었으나 40) (Figs. 6F and G), 최근에는 구강스캐너의 발달로 인해, 인상채득 없이도 구강 내 스캔을 통해서 STL file을 확보할 수 있다.
연조직의 변화를 평가하는 방법은 선형 분석(linear analysis)과 체적 분석(volumetric analysis)으로 나눌 수 있다.
선형측정법(linear measurement)은 중첩된 두 STL 파일에서 관심 부위의 단면을 확보한 후, 기준선(reference line)을 설정하고, 이로부터 일정 거리 상방의 연조직 두께를 측정하는 방식이다.
체적측정법(volumetric measurement)은 중첩된 파일에서 원하는 부위에 임의의 사각형 기둥 형태의 측정 영역을 설정한 후, 스캔된 두 파일 간의 교집합만 남기는 Boolean 기능을 활용하여 해당 영역의 연조직 볼륨 변화를 평가할 수 있다[41] (Figs. 6H and I).
결론
치주성형수술은 단순한 치은 조직의 재배치가 아니라, 환자의 심미적 및 기능적 요구를 충족시키는 복합적이고 정밀한 치료 개념이다. 다양한 술식에 대한 충분한 이해를 바탕으로, 환자의 상태에 맞는 개별화된 접근을 선택하는 것이 치료 성공의 핵심이다. 앞으로는 콜라겐 매트릭스, 혈소판농축섬유소(platelet-rich fibrin; PRF) 등 생체재료의 개발뿐 아니라, 내시경(endoscopic instrument)을 활용한 미세수술 및 인공지능, 로봇기술 등 정밀치의학 요소가 치주치료에 점차 확대 적용될 것으로 전망된다. 이러한 변화는 이미 치주치료의 패러다임을 변화시키고 있으며, 임상가는 지속적인 교육과 최신 술식의 습득을 통해 환자에게 최선의 치료 결과를 제공할 수 있어야 한다.